
|
Читайте также: |
Цель работы: приготовление раствора заданной концентрации.
Теоретическая часть
Раствором (истинным раствором) называется однородная (гомогенная) смесь, состоящая из двух или более компонентов, и продуктов их взаимодействия.
Растворителем называется вещество, фазовое состояние которого совпадает с фазовым состоянием раствора, а при одинаковом фазовом состоянии веществ растворителем считается вещество, содержащееся в большем количестве.
Растворенным называется вещество, фазовое состояние которого не совпадает с фазовым состоянием раствора, а при одинаковом фазовом состоянии – вещество, содержащееся в меньшем количестве.
Концентрацией раствора (С) называется количество растворенного вещества, содержащегося в растворе, в расчете на единицу массы (или объема) раствора или растворителя.
В растворе, не контактирующем с избытком растворенного вещества, концентрация может быть меньше растворимости (С < s, ненасыщенный раствор), равна растворимости (С = s, насыщенный раствор) или больше растворимости (С > s, пересыщенный раствор).
Наиболее часто в практике сельскохозяйственного производства встречаются ненасыщенные растворы.
Различают два основных способа выражения концентраций растворов: массовый и объемный.
Объемные концентрации показывают содержание растворенного вещества в единице объема раствора.
Молярная концентрация (молярность) показывает число моль растворенного вещества в 1 л раствора:
 , где m – масса растворенного вещества, г; М – мольная масса растворенного вещества, г; V– объем раствора, л.
, где m – масса растворенного вещества, г; М – мольная масса растворенного вещества, г; V– объем раствора, л.
Молярная концентрация эквивалента (нормальная концентрация, нормальность) показывает число моль-эквивалентов растворенного вещества в 1 л раствора:
 , где m – масса растворенного вещества, г; Э – мольная масса эквивалента растворенного вещества, г; V– объем раствора, л.
, где m – масса растворенного вещества, г; Э – мольная масса эквивалента растворенного вещества, г; V– объем раствора, л.
Титр показывает число граммов растворенного вещества в 1 мл раствора:
 , где m – масса растворенного вещества, г; V– объем раствора, мл.?
, где m – масса растворенного вещества, г; V– объем раствора, мл.?
Массовые концентрациипоказывают содержание растворенного вещества в единице массы раствора или растворителя.
Массовая доля (процентная концентрация, массовая процентная концентрация) показывает число граммов растворенного вещества в 100 г раствора:
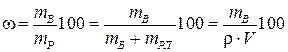 ,
,
где mв – масса растворенного вещества, г; mP = Vρ – масса раствора, г; mрл – масса растворителя, г; ρ – плотность раствора, г/мл; V – объем раствора, мл.
Принятое обозначение: ω = c% = 25 %.
В общем виде  , где w – массовая доля; mi – масса i -го компонента;
, где w – массовая доля; mi – масса i -го компонента;  – сумма масс всех n компонентов раствора (масса раствора).
– сумма масс всех n компонентов раствора (масса раствора).
Моляльная концентрация (моляльность) показывает число моль растворенного вещества в 1000 г растворителя:
 , где cm – моляльная концентрация, m и М – соответственно масса и мольная масса растворенного вещества, г; L – масса растворителя, г.
, где cm – моляльная концентрация, m и М – соответственно масса и мольная масса растворенного вещества, г; L – масса растворителя, г.
Переход от одного способа выражения концентрации к другому производят по формулам:
 ;
;  ;
;  ;
;  ;
;  ;
;
 ;
;  ;
;  ;
; 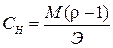 ;
;  ;
;
 ;
;  ;
;  ;
;  ;
;  .
.
Дата добавления: 2015-07-11; просмотров: 88 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Давление насыщенного водяного пара | | | Масса растворенного в 1 л вещества не зависит от способа выражения концентрации |