
Читайте также:
|
Теория (оформляется с использованием: Лабораторного практикума по курсу химии для технических университетов, МГТУ,2005, ч.1, стр.71-89, конспекта лекций, учебника)
1. Дайте определение электролитам:
2. Дайте определение электролитической диссоциации:
3. Дайте определение степени диссоциации (α) и приведите формулу для ее расчета:
4. Дайте определение сильным электролитам. Укажите значение α:
5. Приведите формулы веществ – сильных электролитов:
6. Дайте определение слабым электролитам. Укажите значение α:
7. Приведите формулы веществ – слабых электролитов:
8. Приведите уравнение процесса электролитической диссоциации (в общем виде):
9. Приведите формулы для расчета констант диссоциации аналитической (Кд,с) и термодинамической (Кд,a). Для каких электролитов используется выражение Кд,с ?
10. Приведите формулу для расчета коэффициента активности (γ =f):
11. Приведите уравнения, отражающие процесс диссоциации многоосновной кислоты или многокислотного основания по двум ступеням. Напишите выражение соответственно Ка(I) или Кb(I) по первой и Ка(II) или Кb(II) по второй ступеням.
12. Приведите общее уравнение диссоциации и выражение общей Ка или Кb для приведенного Вами уравнения:
13. Приведите выражение ионного произведения воды при 298 К:
14. Приведите выражения водородного и гидроксидного показателей:
15. Дайте определение произведению растворимости (ПР):
16. Приведите выражение произведения растворимости ПР (в общем виде):
17. Укажите условия образования осадка:
18. Дайте определение процессу гидролиза:
19. Приведите пример гидролиза соли, образованной сильной кислотой и сильным основанием. Напишите уравнение реакции в молекулярном виде.
20. Приведите пример гидролиза по аниону соли, образованной слабой кислотой и сильным основанием по первой ступени. Напишите уравнение реакции в молекулярном, ионно-молекулярном и сокращенном ионно-молекулярном виде.
21. Приведите пример гидролиза по катиону соли, образованной слабым основанием и сильной кислотой по первой ступени. Напишите уравнение реакции в молекулярном, ионно-молекулярном и сокращенном ионно-молекулярном виде.
22. Приведите пример гидролиза соли, образованной слабой кислотой и слабым основанием. Напишите уравнение реакции в молекулярном, ионно-молекулярном и сокращенном ионно-молекулярном виде.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт 1. Определение направления протекания реакций с участием электролитов
Основные понятия: сильный электролит, слабый электролит, константа диссоциации
1) Реагенты: NH4Cl, NaOH.
Уравнение реакции:
Наблюдения:
Сильные электролиты:
Слабые электролиты: (K b(NH4OH)=1,77 ×10–5)
2) Реагенты: CH3COONa, HCl.
Уравнение реакции:
Наблюдения:
Сильные электролиты:
Слабые электролиты: (K а(СН3СООН)=1,86×10–5)
Выводы: (указывают направление протекания изученных реакций, используя данные по константам диссоциации соответствующих электролитов)
Опыт 2. Определение и сравнение рН растворов сильных и слабых электролитов
Основные понятия: водородный показатель рН, гидроксидный показатель рОН, связь между ними, степень диссоциации.
Расчетные формулы: для кислот: a = 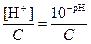 ; для оснований a =
; для оснований a = 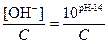
Таблица 1. Результаты измерения рН и расчета степени диссоциации электролита
| Электролит | Уравнение диссоциации | Концентрация раствора С, моль/л | рН | Степень диссоциации a |
| HCl | 0,1 | |||
| CH3COOH | 0,1 | |||
| NaOH | 0,1 | |||
| NH4OH | 0,1 |
Расчеты:
Выводы: (сравнивают рН и степень диссоциации соответствующих кислот и оснований)
Опыт 3. Смещение равновесия диссоциации слабого электролита
Основные понятия: принцип Ле- Шателье смещения положения химического равновесия
Таблица 2. Результаты измерения рН растворов
| Изменения после добавления сильного электролита к слабому электролиту | |||||
| Электролит | Уравнение диссоциации | Увеличилась концентрация иона | Изменилось значение рН раствора | Равновесие диссоциации сместилось | |
| Слабый | CH3COOH | рН1 = | |||
| Сильный | CH3COONa | рН2 = | |||
| Слабый | NH4OH | рН1 = | |||
| Сильный | NH4Cl | рН2 = |
Выводы: (отмечают влияние сильного электролита с одноименным ионом на положение равновесия диссоциации слабого электролита и степень его диссоциации)
Опыт 4. Получение и растворение осадков труднорастворимых электролитов
Основные понятия: произведение растворимости ПР, условия образования и растворения осадка.
а) Реагенты: CaCl2, Na2CO3
Уравнение реакции:
Наблюдения:
Выражение ПР соли, выпавшей в осадок:
Расчет произведения концентраций соответствующих ионов и сравнение с величиной ПР(СаСО3) = 3,8×10–9:
Вывод: (отмечают условие выпадения осадка)
б) Реагенты: продукты реакции (а), HCl
Уравнение реакции:
Сравнение силы соответствующих кислот: HCl Н2СО3 (K а (I)(Н2СО3) = 4,3×10–7)
в) Реагенты: продукты реакции (а), СН3СООН (K а (II)(Н2СО3) =5,6×10–11)
Уравнение реакции:
Сравнение силы соответствующих кислот:
СН3СООН(K а(СН3СООН) = 1,86×10–5) Н2СО3 (K а(I)(Н2СО3) = 4,3×10–7 )
Вывод: (отмечают условие растворения осадка) (K а (II)(Н2СО3) =5,6×10–11)
Опыт 5. Влияние природы соли на процесс гидролиза
Основные понятия: степень гидролиза
а) Соль: NaCl
Определение рН раствора:
б) Соль: MgCl2
Определение рН раствора:
Уравнение гидролиза (по I ступени):
в) Соль: AlCl3
Определение рН раствора:
Уравнение гидролиза (по I ступени):
г) Соль: Na2CO3
Определение рН раствора:
Уравнение гидролиза (по I ступени):
Сравнение силы соответствующих оснований:
NaOH Mg(OH)2 (K b (I)(Mg(OH)2)=2,5×10–3) Al(OH)3 (K b (I)(Al(OH)3)=1,0×10–9)
Выводы: (указывают, как степень гидролиза соли и. соответственно, рН раствора зависят от силы соответствующего основания или кислоты)
Опыт 6. Влияние температуры на степень гидролиза
Основные понятия: степень гидролиза, тепловой эффект химической реакции, принцип Ле Шателье смешения положения химического равновесия.
Соль: СН3СООNa. Индикатор: фенолфталеин. Условия проведения опыта: нагревание
Уравнение гидролиза:
Наблюдения:
Выводы: (отмечают смещение положения равновесия гидролиза при повышении температуры, показывают, как зависит степень гидролиза от температуры, каков знак теплового эффекта процесса)
Не забудьте у преподавателя получить контрольные вопросы!
Дата добавления: 2015-07-11; просмотров: 67 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Измеренные величины. | | | Часть первая |