
|
Читайте также: |
Гидролизом называют обменное взаимодействие соли с водой, протекающее с образованием слабого электролита или его соли. Гидролиз сопровождается изменением рН раствора. Реакция гидролиза является обратной реакции нейтрализации (реакции между кислотой и основанием). Гидролиз, как и диссоциация, может протекать ступенчато. Количественными характеристиками гидролиза являются константа гидролиза (Кг) и степень гидролиза (αг).
Степенью гидролиза (αг) называют отношение молярной концентрации прогидролизовавшейся соли (Сг) к общей концентрации соли (Со) в растворе, которое выражают в долях или в процентах:
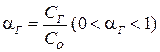 , доли;
, доли; 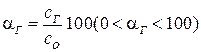 , %.
, %.
Степень гидролиза возрастает с увеличением температуры и уменьшением концентрации электролита. Гидролиз протекает легче всего по первой ступени.
Константой гидролиза называется константа равновесия реакции гидролиза.
Константу гидролиза можно рассчитать, зная константу диссоциации соответствующего слабого электролита:
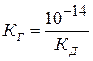 , где Кд – константа диссоциации слабого электролита. (соотв. ступени??)
, где Кд – константа диссоциации слабого электролита. (соотв. ступени??)
Константа и степень гидролиза связаны соотношением, аналогичным закону разбавления Оствальда: (лучше заменить 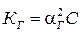 на hг2 х СМ)
на hг2 х СМ)
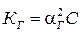 , где С– молярная концентрация электролита, моль/л; αг – степень гидролиза соли, долей.
, где С– молярная концентрация электролита, моль/л; αг – степень гидролиза соли, долей.
Характер гидролиза растворенного вещества определяется природой соли (должен. вмолекуле соли присутствовать остаток от слабого электролита)
Соли, образованные сильными электролитами, например, NaCl, K2SO4, NaNO3, KCl гидролизу не подвергаются.
Уравнение гидролиза записывают в трех видах: молекулярном, полном ионном и сокращенном ионном. Тип гидролиза определяется типом слабого электролита, а реакция раствора (кислая, щелочная, нейтральная) – типом сильного электролита.
Различают три типа гидролиза:
1. Гидролиз по аниону (соль слабой кислоты и сильного основания), например:
I ступень: К2СО3 + Н2О ⇄ КНСО3 + КОН (молекулярная форма);
2К+ + СО32– + Н2О ⇄ К+ + НСО3– + К+ + ОН– (полная ионная форма);
СО32– + Н2О ⇄ НСО3– + ОН– (сокращенная ионная форма);
II ступень: КНСО3 + Н2О ⇄ Н2СО3 + КОН;
К+ + НСО3– + Н2О ⇄ Н2СО3 + К+ + ОН–;
НСО3– + Н2О ⇄ Н2СО3 + ОН–.
Поскольку в реакцию гидролиза вступает анион – это гидролиз по аниону (из воды связывается Н+, избыток ОН- создают щелочную среду, рН >7) а образование избытка свободных ионов гидроксила ОН– обуславливает щелочную среду(рН > 7).
2. Гидролиз по катиону (соль слабого основания и сильной кислоты), например:
I ступень: FeCl2 + Н2О ⇄ FeOHCl + HCl (молекулярная форма);
Fe2+ + 2Cl– + Н2О ⇄ FeOH+ + Cl– + H+ + Cl– (полная ионная форма);
Fe2+ + Н2О ⇄ FeOH+ + H+(сокращенная ионная форма);
II ступень: FeOHCl + Н2О ⇄ Fe(OH)2 + HCl (молекулярная форма);
FeOH+ + Cl– + Н2О ⇄ Fe(OH)2 + H+ + Cl– (полная ионная форма);
FeOH+ + Н2О ⇄ Fe(OH)2 + H+ (сокращенная ионная форма);
Поскольку в реакцию гидролиза вступает катион – это гидролиз по катиону, а образование избытка свободных ионов водорода H+ –обуславливают кислую среду (рН < 7).
3. Гидролиз по катиону и аниону (соль слабого основания и слабой кислоты), например:
(NH4)2CО3 + 2Н2О ⇄ 2NH4OH + Н2СО3; добавить
2NH4+ + CО32– + 2Н2О ⇄ 2NH4OH + Н2СО3 . 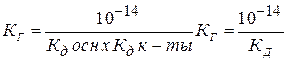
Поскольку в реакцию гидролиза вступают катион и анион – это гидролиз по катиону и аниону, а образуются два слабых электролита – среда близка к нейтральной (рН 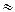 7). Один из электролитов всегда диссоциирует несколько лучше другого, поэтому среда либо слабощелочная, либо слабокислая.
7). Один из электролитов всегда диссоциирует несколько лучше другого, поэтому среда либо слабощелочная, либо слабокислая.
Экспериментальная часть
Дата добавления: 2015-07-11; просмотров: 111 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Диссоциация электролитов | | | Опыт 1. Определение количественных характеристик диссоциации растворов кислот и оснований. |