
|
Читайте также: |
1. Получите задание у преподавателя (электролиты, характеристики которых необходимо определить, и их молярные концентрации см), данные запишите в таблицу.
2. Определите рН заданных растворов с помощью универсальной индикаторной бумаги. Для этого полоску индикаторной бумаги опустите в исследуемый раствор на 1…2 секунды и сравните окраску индикатора с цветной шкалой, установив примерную величину рН раствора, данные запишите в таблицу.
3. Выясните у преподавателя правила работы с рН-метром и затем определите рН заданных растворов с помощью рН-метра с точностью до 0,1 единицы рН, данные запишите в таблицу. При определении характеристик слабых электролитов выпишите из справочной таблицы, приведенной в конце описания лабораторной работы, значения их констант диссоциации (Кд) и затем сравните их с рассчитанными величинами.
| Формула электролита | СМ моль/л | Значение рН | [H+], моль/л | [OH–], моль/л | αд, % | Кд | |
| по инд. бум. | по рН-метру | ||||||
Напишите уравнения диссоциации:
4. Рассчитайте [H+], [OH–], αд, Кд.
Расчет проводят по более точному значению рН, измеренному по рН-метру. Концентрации ионов [H+] и [OH–]определяют по формулам:
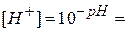
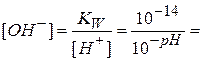
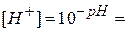
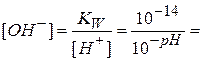
Для слабых электролитов, диссоциирующих по первой ступени, степень диссоциации αд и константу диссоциации Кд рассчитывают по формулам:
для слабой кислоты:
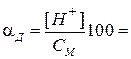
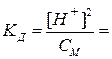
для слабого основания:
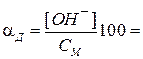
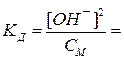
для сильной кислоты:
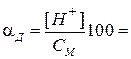
для сильного основания:
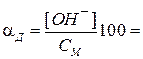
Константы диссоциации сильных электролитов не рассчитываются и в таблице не указываются.
Дата добавления: 2015-07-11; просмотров: 132 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гидролиз солей | | | Опыт 2. Определение количественных характеристик гидролиза |