
Читайте также:
|
Цель работы: определение константы скорости реакции.
Теоретическая часть
Химическая кинетика – раздел химии, описывающий определение скорости и механизма химических реакций.
Мгновенной скоростью химической реакции называется первая производная молярной концентрации одного из исходных или конечных веществ по времени:
 , где V – скорость реакции, C – молярная концентрация, моль/л; t – время, сек.
, где V – скорость реакции, C – молярная концентрация, моль/л; t – время, сек.
Скорость химической реакции (обычно рассматривают зависимость мгновенной скорости) зависит от многих факторов: природы реагирующих веществ, концентраций реагирующих веществ, температуры, присутствия катализатора и др.
Механизмом реакции называют совокупность стадий химической реакции, в результате которых исходные вещества превращаются в конечные. Реакции могут быть одностадийными и многостадийными. Скорость реакции определяется скоростью самой медленной ее стадии (лимитирующей стадии).
Различают гомогенныеигетерогенныехимические реакции. Реакции, протекающие в однофазной (однородной) системе, например, жидкой или газообразной, называются гомогенными. Такие реакции протекают во всем объеме системы. Реакции, протекающие в многофазных системах (состоящих из двух или более фаз, например, газообразной и твердой фазы) называются гетерогенными. Такие реакции протекают только на поверхности раздела фаз. Скорость гетерогенной реакции определяется изменением концентрации реагирующих веществ на единице поверхности в единицу времени.
Зависимость скорости реакции от концентрации объясняется тем, что необходимым условием химического взаимодействия молекул является их столкновение. Скорость реакции пропорциональна числу столкновений молекул реагирующих веществ. Число столкновений, а значит и скорость реакции, в первую очередь зависят от концентрации веществ. Эту зависимость выражает закон действующих масс: скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в степенях, равным соответствующим стехиометрическим коэффициентам. Закон действующих масс – основной закон химической кинетики для гомогенных реакций. Для реакции
aA + bB ⇄ cC + dD,
где А и B – исходные вещества; D и С – продукты реакции; a, b, c, d – стехиометрические коэффициенты в уравнении реакции, закон действующих масс имеет вид:

Эти уравнения называются кинетическими уравнениями. В них V1 и V2 – скорости прямой и обратной реакции; k 1 и k 2 – константы скорости прямой и обратной реакции соответственно; [A], [B], [C], [D] – концентрации соответствующих веществ. Физический смысл k – скорость реакции при концентрациях реагирующих веществ, равных 1 моль/л. Для гетерогенных реакций кинетические уравнения записываются без учета концентраций твердых веществ, потому что концентрации твердых веществ не меняются в ходе реакции (остаются постоянными) и не влияют на скорость реакции, например:
1) 2NO(Г) + O2(Г) = 2NO2(Г); 2) С(Т) + O2(Г) = СO2(Г);



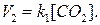
Показатель степени при концентрации в кинетическом уравнении называется порядком реакции по данному компоненту. Например, порядок реакции (1) по окисиду азота (II) (NO) равен 2, а по кислороду – 1. Для обратной реакции порядок по оксиду азота (IV) (NO2) равен 2. Для реакции (2) порядок по кислороду для прямой реакции и по углекислому газу для обратной реакции равен 1. При этом твердый углерод не учитывается при записи кинетического уравнения. Сумма показателей степеней при концентрациях в кинетическом уравнении называется порядком реакции. Для реакции (1) порядок равен
1 + 2 = 3.
В многостадийных реакциях порядок реакции может быть дробным, но не более 3.
Молекулярностью реакции называется число частиц, участвующих в элементарном акте химического взаимодействия. В реальных реакциях молекулярность может быть равна 1, 2, 3. В простых реакциях, протекающих в одну стадию, порядок совпадает с молекулярностью. Закон действующих масс справедлив для простых реакций. В случае сложных реакций, протекающих в несколько стадий, закон применим к любой отдельной реакции, но не к их сумме.
Зависимость скорости реакции от температуры объясняется тем, что, как уже отмечалось, скорость реакции зависит от числа соударений участвующих в реакции частиц (атомов, молекул, ионов). Но не все соударения приводят к химическому взаимодействию. Для того чтобы реакция произошла, частицы должны обладать некоторым избыточным количеством энергии (по сравнению со средней величиной), называемым энергией активации (EА). Чем выше температура, тем больше частиц имеет энергию, большую или равную EА. Поэтому скорость реакции увеличивается с повышением температуры. Константа скорости химической реакции определяется числом эффективных столкновений, т.е. числом активных молекул, способных вступить в химическую реакцию. Зависимость константы скорости реакции от температуры и энергии активации выражается уравнением Аррениуса:
 ,
,
где k – константа скорости реакции, Z – постоянная, называемая стерическим фактором и зависящая от числа столкновений, приводящих к реакции; е – основание натурального логарифма (е = 2,7183...); 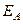 – энергия активации, Дж/моль; R – газовая постоянная (R = 8,314 Дж/К·моль), Т – температура, К.
– энергия активации, Дж/моль; R – газовая постоянная (R = 8,314 Дж/К·моль), Т – температура, К.
При комнатной температуре обычно проходят реакции, для которых EA = 60…105 кДж/моль, а доля активных молекул (т.е. отношение числа активных молекул к общему числу молекул) составляет 3,6∙10–11…5,2∙10–19.
Влияние катализатора на скорость реакции наиболее велико. Катализатором называют вещество, которое не расходуется в химической реакции, но изменяет ее скорость. Катализаторы могут ускорять реакцию (положительные катализаторы, катализаторы) или замедлять ее (отрицательные катализаторы, ингибиторы). Механизм действия катализаторов не вполне ясен, однако обнаружено, что положительные катализаторы понижают энергию активации, что приводит к увеличению числа частиц, способных вступить в реакцию, а отрицательные катализаторы понижают ее. Зависимость скорости реакции от природы и количества катализатора определяется, как правило, экспериментально.
Экспериментальная часть
Дата добавления: 2015-07-11; просмотров: 75 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт 2. Определение количественных характеристик гидролиза | | | Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ |