
Читайте также:
|
Реакции алкилирования лежат в основе производства многих важнейших продуктов органического синтеза. Эти продукты являются не только исходными веществами для дальнейших синтезов, но и широко используются в качестве компонентов моторных топлив, растворителей, пластификаторов, присадок к маслам и других целей.
Разнообразие продуктов алкилирования обусловлено тем, что реакцию алкилирование можно осуществить не только по атому углерода, но и по атомам кислорода, серы, азота, кремния, свинца, алюминия и многих других элементов:
ArH+RCl→ArR+НСl
ArOH+RCl+NaOH→ArOR+NaCl+H2O
NaSH+RCl→RSH+NaCl
ROH+NH3→RNH2+H2O
Si+2RCl→RSiCl2
4PbNa+4C2H5Cl→Pb(C2H5)4+4NaCl+3Pb
Al+3C3H6+1,5H2→Al(C3H7)3
Причем в процессах алкилирования в молекулу алкилируемого вещества можно ввести различные функциональные группы: олефиновую, гидроксильную, карбоксильную и др. Например:
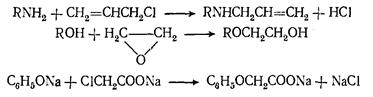
В промышленности процессы алкилирования проводят как в жидкой, так и в газовой фазах в широких пределах температур (0—600°С) и давлений (0,1—7 МПа) с использованием разнообразных алкилирующих реагентов и катализаторов. Обычно в качестве алкилирующих веществ используют олефины, ацетилен, спирты, этиленоксид и алкилхлориды, а в качестве катализаторов минеральные кислоты (H2SO4 и HF), апротонные кислоты (Аl2Сl3 и ВF3), щелочи и т. д.
Этилбензол среди продуктов нефтехимического синтеза занимает важное место, являясь промежуточным продуктом для производства стирола — ценного мономера для производства пластических масс, синтетического каучука и других полимерных материалов. Основным промышленным методом производства этилбензола является процесс жидкофазного алкилирования бензола этиленом в присутствии катализаторного комплекса на основе хлорида алюминия:
C6H6+CH2=CH2  C6H5-CH2CH3
C6H5-CH2CH3
Изопропилбензол также является важным продуктом нефтехимического синтеза. На его основе в промышленности получают α - метилстирол и основное количество фенола и ацетона. Изопропилбензол получают алкилированием бензола пропиленом. При алкилировании бензола этиленом (пропиленом) главными побочными продуктами являются ди- и полиалкилбензолы, которые образуются в результате дальнейшего алкилирования моноалкилбензола:
C6H5-CH2CH3  C6H4(CH2CH3)2
C6H4(CH2CH3)2  C6H3(CH2CH3)3 и т.д.
C6H3(CH2CH3)3 и т.д.
Выход полиалкилбензолов зависит от мольного отношения олефина к бензолу. Однако важно то, что полиалкилбензолы в присутствии комплекса хлорида алюминия вступают с бензолом в обратимую реакцию с образованием моноалкилбензола (диспропорционирование или переалкилирование):
С6Н4(СН2СН3)2+С6Н6  2С6Н5-СН2СН3
2С6Н5-СН2СН3
Поэтому при алкилировании бензола в присутствии хлорида алюминия мольное отношение этилена (пропилена) к бензолу доводят до 0,3—0,4, а побочно образовавшиеся полиалкилбензолы (10—15% масс.) выделяют и возвращают в процесс, где они в присутствии комплекса хлорида алюминия и бензола подвергаются деалкилированию с образованием целевого продукта.
Твердый сухой хлорид алюминия в углеводородах практически нерастворим, а поэтому его каталитические свойства выражены очень слабо. Однако при нагревании хлорида алюминия в алкилароматическом углеводороде в присутствии хлорида водорода образуется темное жидкое вещество (комплекс Густавсона), которое также нерастворимо в избытке углеводорода, но обладает высокой каталитической активностью.

Для получения катализаторного комплекса вместо свободного хлорида водорода можно использовать алкилхлориды или немного воды, которая при взаимодействии с хлоридом алюминия генерирует хлорид водорода. Однако использование воды нежелательно, так как она частично дезактивирует хлорид алюминия:
АlСl3+Н2О→АlОСl+2НСl
Необходимый для реакции алкилирования ион карбония может образоваться несколькими путями, например
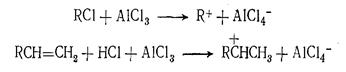
или при взаимодействии олефина с протоном σ-комплекса, входящего в состав катализаторного комплекса.
Ион карбония, образовавшийся одним из этих путей, атакует ароматическое ядро с образованием вначале σ-комплекса, который затем переходит в σ-комплекс (ион карбония), а последний быстро распадается на алкилароматическое соединение и протон:

Дата добавления: 2015-07-10; просмотров: 265 | Нарушение авторских прав