
Читайте также:
|
Скорость химической реакции может измениться не только при изменении концентрации реагирующих веществ, но и при изменении константы скорости реакции (уравнение 2). Последняя зависит от температуры. Количественно влияние температуры на константу скорости реакции можно приблизительно оценить величиной температурного коэффициента Υ, изменяющегося в пределах от 2 до 4. При повышении температуры на 100С константа скорости реакции, а, следовательно, пропорциональная ей величина скорости реакции, при одинаковых начальных концентрациях реагирующих веществ, возрастает в 2…4 раза (правило Вант-Гоффа):
 или
или 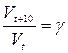 , (3)
, (3)
где kt – константа скорости реакции при температуре t0C и соответствующая ей скорость реакции Vt;
kt+10 – константа скорости реакции при температуре t0 + K0 и соответствующая ей скорость реакции V t+10
При повышении температуры до t0 градуса изменение скорости реакции можно записать следующим образом:

 , (4)
, (4)
где V1 – скорость реакции при температуре t1;
V2 – скорость реакции при температуре t2
Пример Во сколько раз изменится скорость некоторой реакции при повышении температуры от 0 до 300С, если при 00С V0 = 1 моль/лс, а γ – 2?
Найдем скорость химической реакции при t = 300С. Для этого подставим данные в уравнение (4):

 =
=  = 8 моль/л∙с
= 8 моль/л∙с
Отношение 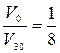 или V30 = 8 · V0, т.е при повышении температуры на 300С скорость реакции возросла в 8 раз.
или V30 = 8 · V0, т.е при повышении температуры на 300С скорость реакции возросла в 8 раз.
Дата добавления: 2015-07-12; просмотров: 145 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ХИМИЧЕСКАЯ КИНЕТИКА | | | ХИМИЧЕСКОЕ РАВНОВЕСИЕ |