
Читайте также:
|
В две пробирки поместить немного металлического цинка. В одну пробирку добавить 2-3 капли разбавленной серной кислоты, а в другую – концентрированной серной кислоты (под тягой!) и немного нагреть. Что происходит? Написать уравнения реакций.
Упражнения и задачи
1) Составить уравнения полуреакций окисления и восстановления для следующих реакций и определить, в каких случаях водород служит окислителем и в каких – восстановителем:
а) Al + HCl → AlCl3 + H2
б) Н2 + О2 → Н2О
в) Na + Н2О → NaOH + H2
г) BaH2 + Н2О → Ba(OH)2 + H2
2) Составить уравнения полуреакций окисления или восстановления с учетом кислотности среды:
а) кислая среда б) нейтральная среда в) щелочная среда
NO3- ® NO2 NO2- ® NO3- СrO2- ® CrO42-
MnO4- ® Mn2+ MnO4- ® MnO2 Al ® AlO2-
Cr3+ ® Cr2O72- SO32- ® SO42- NO3- ® NH3
3) Составьте уравнения полуреакций:
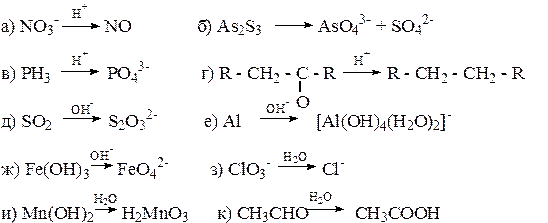
4) Составьте единые сокращенные ионно-молекулярные уравнения:
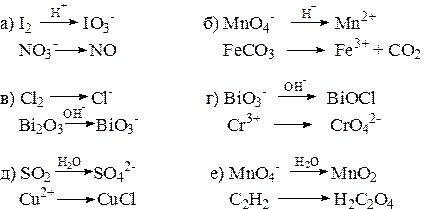
5) Методом полуреакций подберите коэффициенты в уравнениях ОВР:
CrCl3 + H2O2 + NaOH ® Na2CrO4 + NaCl + H2O
H2O2 + K2Cr2O7 + H2SO4 ® Cr2(SO4)3 + O2 + K2SO4 +Н2О
Na2S + Ca(ClO)2 + H2O ® S + CaCl2 + NaOH
Mn(NO3)2 + AgNO3 + NH4OH ® MnO2 + Ag + NH4NO3+Н2О
Cr2O3 + K3[Fe(CN)6] + KOH ® K2CrO4 + K4[Fe(CN)6] + H2O
K4[Fe(CN)6] + Cl2 ® K3[Fe(CN)6] +KCl
6) Используя метод электронно-ионного баланса, составьте полные уравнения следующих ОВР:
FeSO4 + HNO3 + H2SO4 ® Fe3+ + NO + …
Al + KNO3 + KOH + H2O ® [Al(OH)4]- + NH4OH + …
SO2 + KMnO4 + H2O ® SO42- + Mn2+ + …
Zn + KClO3 + KOH + H2O ® [Zn(OH)4]2 +…
NaHSO3 + Cl2 + H2O ® HSO4- + Cl- + …
SnCl2 + K2Cr2O7 + KOH ® Sn4+ + [Cr(OH)6]3- +…
PH3 + KMnO4 + H2SO4 ® H3PO4 + …
Si + NaOH + H2O ® SiO32- + H2 +…
H2S + HNO3 ® SO42- + NO + …
KI + NaOCl + H2SO4 ® I2 + Cl- + …
7) Составьте уравнения окислительно-восстановительных реакций с участием органических веществ:
С2H5OH + HNO3 ® CO2 + NO2 + …
С2H5OH + H2SO4 ® CO2 + SO2 + …
С6H5CH3 + HNO3 ® С6H5COOH + NO + …
H2C2O4 + HNO3 ® CO2 + NO + …
C6H12O6 + HNO3 ® CO2 + NO2 + …
C6H12O6 + H2SO4 ® CO2 + SO2 + …
CH3OH + KMnO4 + H2SO4 ® HCOOH + Mn2+ + …
C3H8O3 + K2Cr2O7 + H2SO4 ® CO2 + Cr3+ + …
8) Составьте уравнения окислительно-восстановительных реакций с участием пероксида водорода:
H2O2 + KMnO4 + H2SO4 ® О2 + Mn2+ + …
H2O2 + K2Cr2O7 + H2SO4 ® О2 + Cr3+ + …
H2O2 + Na2CrO4 + NaOH ® О2 + CrO2- + …
H2S + H2O2 ® SO42- + H2O + …
MnSO4 + H2O2 + KOH ® MnO42- + H2O + …
9) Напишите уравнения реакций между следующими веществами:
а) сульфатом железа (II) и кислородом воздуха в кислой среде;
б) сульфидом аммония и хлором в водном растворе;
в) иодидом магния и пероксидом водорода в кислой среде;
г) сульфатом хрома (III) и бромом в щелочной среде;
д) азотной кислотой и пиритом FeS2;
е) сульфидом цинка и бромом в щелочной среде.
10) Закончить уравнения реакций, в которых окислителем служит концентрированная азотная кислота:
а) С + HNO3 ® CO2 + …
б) Sb + HNO3 ® HSbO3 + …
в) Bi + HNO3 ® Bi(NO3)3 + …
г) PbS + HNO3 ® PbSO4 + NO2 + …
11) Закончить уравнения реакций, в которых окислителем служит концентрированная серная кислота:
а) HBr + H2SO4 = Br2 + …
б) S + H2SO4 = SO2 + …
в) Mg + H2SO4 = MgSO4 + …
12) Закончить уравнения реакций, написать уравнения в ионно-молекулярной форме:
а) K2S + K2MnO4 + H2O ® S + …
б) NO2 + KMnO4 + H2O ® KNO3 + …
в) KI + K2Cr2O7 + H2SO4 ® I2 + …
г) Ni(OH)2 + NaClO + H2O ® Ni(OH)3 + …
д) Zn + H2AsO3 + H2SO4 ® AsH3 + …
13) Закончить уравнения реакций. Обратить внимание на окислительно-восстановительную двойственность элементов, находящихся в промежуточной степени окисленности:
а) KI + KNO2 + CH3COOH ® NO + …
KMnO4 + KNO2 + H2SO4 ® KNO3 + …
б) H2SO3 + Cl2 + H2O ® H2SO4 + …
H2SO3 + H2S ® S + …
в) Na2S2O3 + I2 ® Na2S4O6 + …
Cl2 + I2 + H2O ® HIO3 + …
14) Закончить уравнения реакций, учитывая, что восстановитель содержит два окисляющихся элемента:
а) Cu2S + HNO3 (конц.) ® H2SO4 + …
б) FeS2 + O2 ® …
в) FeO × Cr2O3 + K2CO3 + O2 ® K2CrO4 + Fe2O3 + …
г) FeSO3 + KMnO4 + H2SO4 ® Fe2(SO4)3 + …
15) Закончить уравнения реакций, записать их в молекулярной форме:
а) C2O42- + I2 ® CO2 + …
б) BiO3- + Cr3+ + H+ ® Bi3+ + Cr2O72- + …
в) SeO32- + I- + H2O ® Se + …
г) IO3- + SO2 + H2O ® …
16) Закончить уравнения реакций, записать их в ионно-молекулярной форме:
а) FeSO4 + O2 + H2O ® …
б) P + KMnO4 + H2O ® KH2PO4 + K2HPO4 + …
в) Mn(NO3)2 + NaBiO3 + HNO3 ® HMnO4 + …
г) FeS2 + HNO3(конц.) ® H2SO4…
д) (NH4)2Cr2O7 ® N2 + …
17) Вычислить эквивалентную массу H2SO4 в следующих реакциях:
а) Zn + H2SO4 (разб.) = ZnSO4 + H2
б) 2HBr + H2SO4 (конц.) = Br2 + SO2 + 2H2O
в) 8HI + H2SO4 (конц.) = 2I2 + H2S + 4H2O
18) Вычислить эквивалентные массы следующих восстановителей: хлорида олова (II); фосфора, если он окисляется до H3PO4; пероксида водорода, окисляющегося до молекулярного кислорода.
19) Чему равны эквивалент и эквивалентная масса перхлората калия KClO4, если он восстанавливается:
а) до диоксида хлора;
б) до свободного хлора;
в) до хлорид-иона?
Библиография
1. Хомченко Г.П., Цитович И.К. Неорганическая химия. – М.: Высшая школа, 1994. – С.186-202.
2. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1994. – С.156-173, 218-252.
3. Зайцев О.С. Задачи, упражнения и вопросы по химии. – М.: Химия, 1996. – С.349-352.
4. Гузей Л.С., Сорокин В.В. Окислительно-восстановительные реакции. – Издательство МГУ, 1992. – 16с.
Дата добавления: 2015-07-12; просмотров: 385 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Окислительные свойства перманганата калия в различных средах | | | КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ |