
Читайте также:
|

Реакция не происходит, так как нет связывания ионов.
Для количественной оценки поведения электролитов в водных растворах в зависимости от их природы используются различные характеристики (степень диссоциации a, константа диссоциации Кдисс.).
В водных растворах слабых электролитов устанавливается равновесие, для которого константа, называемая константой диссоциации, будет равна:

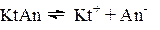
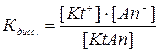 (1)
(1)
Из выражения (1) следует, что Кдисс. будет иметь тем меньшее значение, чем меньше ионов в растворе, т.е. чем слабее электролит.
Степень диссоциации (a) – это отношение количества распавшихся на ионы молекул к общему количеству растворенных молекул.
Константа диссоциации зависит от природы электролита, от природы растворителя, от температуры и не зависит от концентрации, поэтому является более общей характеристикой, чем степень диссоциации. Константа и степень диссоциации связаны между собой законом разбавления Оствальда:
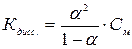 (2)
(2)
где См – молярная концентрация электролита
Если a<<1, то 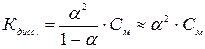 (3)
(3)
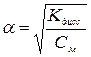 (4)
(4)
Особенности поведения сильных электролитов в водных растворах связаны с их практически полной электролитической диссоциацией, образованием большого числа заряженных частиц – ионов, что приводит к сильному межионному взаимодействию и возникновению эффекта уменьшения числа ионов, участвующих в реакции, особенно с ростом концентрации ионов. Концентрация перестает быть мерой химической активности электролита. В этом случае скорость реакций сильных электролитов зависит не только от концентрации, но и от сил межионного и ион-дипольного взаимодействия. Чтобы учесть их влияние, вместо концентрации используют активность (а). Активность молекул или ионов – это их эффективная концентрация, в соответствии с которой вещество проявляет себя в химических или физических процессах:
 а = f × Cм (5)
а = f × Cм (5)
где f – коэффициент активности, выражает отклонение раствора с концентрацией См от поведения очень разбавленного раствора, в котором отсутствует межионное взаимодействие.
Количественной характеристикой межионных электростатитических взаимодействий является ионная сила (I):
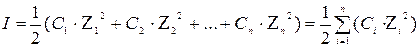 (6)
(6)
где С1, С2, Сn, Ci – коэффициент ионов;
Z1, Z2, Zn, Zi – заряды ионов.
Значения коэффициентов активности приводятся в справочных таблицах. Приближенно коэффициент активности ионов в разбавленных растворах можно вычислить:
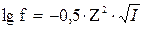 (7)
(7)
Коэффициент активности, следовательно, и активность ионов будет тем меньше, чем больше ионная сила раствора.
Нерастворимые и малорастворимые электролиты характеризуются произведением растворимости (ПР).
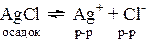
В соответствии с законом действующих масс, в состоянии равновесия скорость прямой 
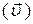 и обратной
и обратной  реакций, равны:
реакций, равны:
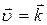
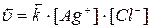
В состоянии равновесия: 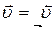
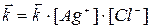
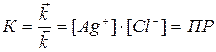 (8)
(8)
где К – константа равновесия..
В общем виде для равновесия:
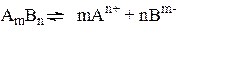
ПР = [An+]m × [Bm-]n (9)
где m и n - число ионов, образующихся в результате диссоциации
1 моля электролитов, ПР – произведение растворимости электролитов.
При смешивании растворов электролитов осадок образуется, если произведение концентраций ионов превысит величину ПР.
В присутствии растворимых сильных электролитов усиливается межионное взаимодействие, увеличивается ионная сила раствора, уменьшаются коэффициенты активности ионов, действующая концентрация становится значительно меньше истинной. В таких случаях в выражении для ПР следует использовать произведение активностей:
ПР = 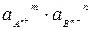 (10)
(10)
ПР= 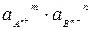 =([An+] fAn+)m ×([Bm-]× fBm-)n=[An+]m×[Bm-]n fm(An+) fn(Bm-) (11)
=([An+] fAn+)m ×([Bm-]× fBm-)n=[An+]m×[Bm-]n fm(An+) fn(Bm-) (11)
Из выражения (12) следует, что в присутствии сильных электролитов концентрации ионов в растворе над осадком увеличиваются, т.е. увеличивается растворимость осадка (солевой эффект), а для его образования потребуется гораздо больше ионов, составляющих малорастворимый электролит:
[An+]m × [Bm-]n = 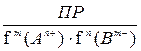 (12)
(12)
Дата добавления: 2015-07-12; просмотров: 161 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Электролитическая диссоциация | | | Упражнения и задачи |