
|
Читайте также: |
Цель работы: приготовить ацетатный буферный раствор с заданным значением pH, экспериментально определить значение pH буферного раствора, определить буферную емкость ацетатного буферного раствора.
Задача: Определить буферную емкость раствора.
Реактивы и 0,1 М растворы NaOH, СН3СООН, СН3СООNa;
оборудование: рН-метр рН-150М; колба на 250 мл; стакан на 50 мл;
стеклянный и вспомогательный электроды; бюретки на 25 мл–3 шт.
1. Подготовить pH – метр к работе.
2. Получить данные у преподавателя для составления ацетатного буферного раствора: значение рН и объем буферного раствора.
3. Рассчитать требуемое количественное соотношение объемов растворов СН3СООН и СН3СООNa по следующим уравнениям:
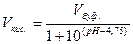 ,
, 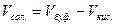 ,
,
где рН – значение рН приготовляемого буферного раствора;
Vкис. – объем кислоты, необходимый для приготовления буферного
раствора, мл;
Vсол. – объем соли, необходимый для приготовления буферного
раствора, мл;
Vбуф. – объем приготовляемого буферного раствора.
3. При помощи бюреток отмерить требуемые объемы растворов в одну колбу и перемешать.
4. Измерить рН приготовленного буферного раствора и вычислить отклонения рН от требуемого значения:
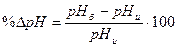
где рНб – требуемое значение рН;
рНи – определенное рН-метром значение.
5. После измерения буферный раствор обратно количественно перенести из измерительного стакана в колбу, добавить из бюретки 2 мл 0,1М раствора NaOH, перемешать и измерить рН.
6. Если значение рН изменилось незначительно (< 0,5 единиц), то буферный раствор обратно перенести в колбу, прибавить еще 2 мл 0,1М раствора NaOH, перемешать и измерить рН. Таким образом добиться изменения рН примерно на одну единицу. Вычислить буферную емкость (В) раствора:
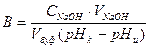 ,
,
где В – буферная емкость раствора, 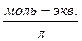 ;
;
СNaOH – концентрация раствора NaOH;
рНи – значение рН буферного раствора до добавления раствора NaOH;
рНк – значение рН буферного раствора после добавления раствора NaOH в количестве VNaOH мл;
Vбуф. – объем приготовляемого буферного раствора.
Дата добавления: 2015-07-12; просмотров: 212 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| РАВНОВЕСНЫЕ ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ | | | ХИМИЧЕСКАЯ КИНЕТИКА |