
Читайте также:
|
Химическая кинетика – учение о скорости и механизме химической реакции, а также о факторах (концентрации, температуре, давлении, катализаторах и т.д.), влияющих на скорость химической реакции. Различают кинетику гомогенных реакций, протекающих равномерно во всем объеме, заполненном веществами, и кинетику гетерогенных реакций, протекающих только на некоторых пограничных поверхностях – на границе раздела фаз. Скорость химических реакций определяется по изменению концентрации либо одного из исходных веществ, либо одного из продуктов реакции в единицу времени. Средняя скорость реакции вычисляется по формуле:
 (1)
(1)
где С1 – молярная концентрация вещества, выраженная в молях на литр, в момент времени t1;
С2 – его молярная концентрация к моменту времени t2.
Время может быть выражено в секундах, минутах, часах в зависимости от скорости протекания реакций. Скорость реакции всегда положительна. Знак минус имеет 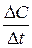 , когда скорость реакции определяется по изменению концентрации одного из исходных веществ, а знак плюс, если скорость реакции определяется по изменению концентрации одного из продуктов реакции.
, когда скорость реакции определяется по изменению концентрации одного из исходных веществ, а знак плюс, если скорость реакции определяется по изменению концентрации одного из продуктов реакции.
Пример Рассчитать среднюю скорость реакции
2KI + Br2 = 2KBr + I2
протекающей в водном растворе, если исходная концентрация составляла 0,4 моль/л, а через 2,5 минуты стала 0,25 моль/л.
Средняя скорость реакции рассчитывается по уравнению (I), в которое подставляются данные, приведенные в задаче
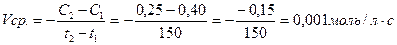
Скорость реакции зависит от концентрации и природы реагирующих веществ, температуры, катализаторов и других факторов.
Дата добавления: 2015-07-12; просмотров: 205 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Определение его буферной емкости | | | Влияние температуры на скорость химической реакции |