
Читайте также:
|
При погружении металлической пластинки в воду ионы металла, находящиеся на поверхности, под действием сил притяжения полярных молекул воды переходят в раствор. Электроны остаются в пластинке. Между металлической пластинкой и ионами металла устанавливается равновесие:
Cu0 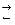 Cu2+ + 2
Cu2+ + 2 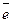 .
.
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл – раствор возникает двойной электрический слой (ДЭС). Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом Е. 
Электродный потенциал металла можно вычислить по формуле Нернста:

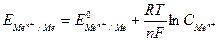 ,
,
где 
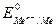 - стандартный электродный потенциал – потенциал электрода в растворе собственных ионов с концентрацией 1 моль/л, В; R – универсальная газовая постоянная, Дж / моль × К; Т – температура, К; n – заряд ионов металла; F – число Фарадея;
- стандартный электродный потенциал – потенциал электрода в растворе собственных ионов с концентрацией 1 моль/л, В; R – универсальная газовая постоянная, Дж / моль × К; Т – температура, К; n – заряд ионов металла; F – число Фарадея; 
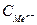 - концентрация ионов металла, моль/л.
- концентрация ионов металла, моль/л.
Величина электродного потенциала зависит от природы металла, заряда его ионов, концентрации ионов металла в растворе, природы растворителя и температуры.
Переходя к десятичным логарифмам и подставляя T = 298 К и соответствующие значения R и F, получаем

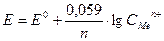 ,
,
где Е0 – стандартный электродный потенциал, В; n – заряд ионов металла; СMen+ – концентрация ионов металла в растворе, моль/л.
Эта формула является основной формулой потенциометрии.
Потенциометрия - метод анализа, основанный на измерении ЭДС и электродных потенциалов как функции концентрации анализируемого раствора. При этом используют гальваническую цепь, составленную из индикаторного электрода, потенциал которого зависит от концентрации определяемого иона в анализируемом растворе, и электрода сравнения, потенциал которого в условиях проведения эксперимента остается постоянным.
Тогда разность потенциалов, которую можно непосредственно измерить, позволяет вычислить потенциал исследуемого электрода:
x = Ех – Ест . ,
где x - измеряемая разность потенциалов; Ех – потенциал исследуемого электрода; Ест . – потенциал электрода сравнения (водородный или другой с известным потенциалом). Так как электродный потенциал зависит от концентрации раствора, то и величина ЭДС элемента будет зависеть от концентрации ионов в исследуемом растворе.
Электроды сравнения (стандартные) обладают постоянным потенциалом (нормальный водородный, каломельный, хлорсеребряный и хингидронный электроды). Простейшим электродом сравнения является нормальный водородный электрод, потенциал которого условно принимается равным нулю (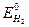 = 0).
= 0).
Электроды измерительные. Для измерения концентрации ионов Н+ в водных растворах существует ряд электродов, обладающих водородной функцией. В настоящее время в лабораторной практике широко применяется стеклянный электрод, так как он обладает рядом преимуществ. Принципиальную схему работы готового стеклянного электрода можно представить себе следующим образом:
стекло  стекло- + Н+.
стекло- + Н+.
Равновесие зависит от рН раствора. Адсорбируясь или десорбируясь ион Н+ изменяет потенциал стеклянного электрода.
Шарик стеклянного электрода заполнен 0,1н. HCl, в него погружена серебряная проволока, поверхность которой покрыта AgCl (хлорсеребряный электрод сравнения). Формула стеклянного электрода:
Ag, AgCl ç 0,1н. HCl ç стеклянная мембрана ç Н+.
Принцип измерения. Для измерения рН раствора составляют цепь из стеклянного электрода, имеющего водородную функцию и стандартногоо - хлорсеребряного электрода.
ЭДС цепи находится в прямой пропорциональной зависимости от рН среды. Поскольку она имеет небольшую величину, то для измерения ее используют специальные потенциометры.
Потенциометр рН-150 М. Лабораторный рН-метр-милливольтметр рН-150М предназначен для определения:
1) рН водных растворов с помощью стеклянных электродов;
2) рХ (показателя концентрации) любых ионов с помощью соответствующих ионоселективных электродов;
3) окислительно–восстановительного потенциала (ОВП) растворов с помощью платинового электрода.
Подготовка рН-150 М к работе.
Реактивы и буферные растворы (рН=1,68 и рН=6,86); насыщенный раствор KCl; пипетка;
оборудование: рН-метр рН-150М; стеклянный и вспомогательный электроды
стакан на 100 мл – 3 шт.; термометр – (0….500);
1. Открыть отверстия вспомогательного электрода и при необходимости долить с помощью пипетки насыщенный раствор KCl.
2. Включить адаптор в сеть и включить прибор.
3. С помощью переключателя «Режим» настроить прибор в режим установки температуры – «0С».
4. Измерить температуру раствора с помощью термометра и с помощью ручки настройки температуры («Температура») на дисплее установить значение температуры раствора.
5. С помощью переключателя «Режим» перевести показания прибора в режим «рН».
Калибровка рН-150 М. 1. Вращая отверткой резистор «рНи», расположенный на боковой стене, установить его примерно в среднее положение.
2. Погрузить электроды в буферный раствор с рН = 1,68 и, вращая ось резистора «БУФЕР», установить на индикаторе значение, равное 1,68.
3. Промыть электроды дистиллированной водой, осушить фильтровальной бумагой и погрузить во второй буферный раствор с рН = 6,86.
4. Вращая ось резистора «S» на боковой стенке прибора, установить на индикаторе значение 6,86.
5. Калибровку необходимо производить методом последовательных приближений, устанавливая последовательно несколько раз сначала ручкой «БУФЕР» значение рН первого буферного раствора, а затем вращая ось резистора «S» - значение второго буферного раствора. Калибровку производить до получения погрешности показаний ±0,05 в обоих растворах.
Дата добавления: 2015-07-12; просмотров: 182 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Упражнения и задачи | | | Определение его буферной емкости |