
|
Читайте также: |
Напомню, что существует два основных вида коррозии – химическая и электрохимическая. Сегодняшняя лекция посвящена химической коррозии.
Химическая коррозия (ХК) – это взаимодействие металлической поверхности с окружающей средой, не сопровождающееся возникновением электрохимических (электродных) процессов на границе фаз. Это обычная гетерогенная ОВР с участием металла и окислителя из окружающей среды. Она может протекать в любых средах и возникновением электрического тока не сопровождается. Этот вид коррозии протекает в основном равномерно по всей поверхности металла. В связи с этим ХК менее опасна, чем ЭХК. Примерами ХК служат ржавление железа и покрытие бронзы патиной. В промышленных условиях металлы нередко нагреваются до высоких температур, что способствует ускорению ХК.
Механизм ХК включает реактивную диффузию атомов или ионов металла сквозь постепенно утолщающуюся пленку продуктов коррозии в окружающую среду и встречную диффузию атомов или ионов окислителя. Этот процесс имеет ионно-электронный механизм, аналогичный процессам электропроводности в ионных кристаллах.
По типу агрессивной среды ХК делится на газовую коррозию (ГК) и коррозию в жидких неэлектролитах (КЖН).
Газовая коррозия.
ГК проходит в среде сухих газов и паров, т.е. без конденсации влаги на поверхности металла, обычно при высоких температурах. Она наблюдается при плавлении и термической обработке металлов, при эксплуатации газовых турбин, химических аппаратов, двигателей внутреннего сгорания и других металлических изделий, на внутренних стенках оборудования для хранения и транспортировки природных газов и в процессах их химической переработки. В связи с этим ГК наносит большой ущерб в различных отраслях, в первую очередь, металлургической, нефтегазовой и химической промышленности.
ГК может протекать в воздухе, в атмосфере водорода, водяных паров, метана и других углеводородов, оксидов углерода и серы, сероводорода, галогенов и их соединений. Наиболее часто на практике встречается газовая коррозия при окислении металлов О2, SO2, H2S, Cl2, НСl, NO3, CO2,CO и H2. При этом образуются соответствующие оксиды, хлориды, нитриды, сульфиды, карбонаты металлов.
Примеры таких реакций:
2Fe + O2 = 2FeO;
Zn + CO2 = ZnO + CO;
Al + H2O = Al2O3 + H2;
3Ni + SO2 = 2NiO + NiS
Fe + Cl2 → FeCl2 или FeCl3.
Самым распространенным окислителем является кислород. Типичным продуктом кислородной ГК является окалина, которая в виде пленки возникает на раскаленных кусках металла при их прокатке.
Процесс ГК, в т.ч. с участием кислорода, включает следующие стадии:
1-я стадия: окисление (ионизация) металла с образованием катионов и электронов, переходящих в оксидную пленку.
2-я стадия: диффузия катионов металла и электронов по направлению к газовой фазе.
3-я стадия: физическая адсорбция кислорода на чистой поверхности металла, приводящая к ослаблению связей между атомами в молекуле кислорода.
4-я стадия: химическая адсорбция, на которой при взаимодействии кислорода с металлом образуется оксидная пленка.
Эта стадия имеет следующий механизм. В соответствии с ионно-электронной теорией окисления Вагнера в оксидной пленке происходит встречная диффузия ионов металла и кислорода. При этом поверхность металла является анодом, на ней протекает реакция окисления атомов металла. Катионы металла и освободившиеся электроны перемещаются в пленке раздельно:
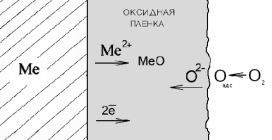
Адсорбировавшиеся на поверхности пленки молекулы кислорода распадаются на атомы, которые проникают внутрь оксидной пленки, где восстанавливаются по реакции: О + 2е = О2−.
5-я стадия диффузия ионов О2− вглубь пленки.
6-я стадия: взаимодействие ионов О2− с катионами металла, приводящее к образованию оксида.
Таким образом, внешняя поверхность пленки, на которой кислород принимает электроны, является катодом. Следовательно, встречная диффузия ионов металла и кислорода протекает в электрическом поле.
Образование оксидной пленки может происходить:
а) на поверхности металла, если преобладает скорость диффузии кислорода;
б) на поверхности оксидной пленки, если преобладает скорость диффузии ионов металла;
в) внутри оксидной пленки. Этот случай наиболее распространен, т.к. в большинстве случаев скорости диффузии кислорода и ионов металла соизмеримы.
Скорость газовой коррозии обычно выражают через скорость роста оксидной пленки:
Vгк = dх/dτ,
где х – толщина оксидной пленки; τ – время окисления металла.
Толщина пленки может быть самой различной. Она зависит от сплошности первично образующейся пленки, которая определяет способность этой пленки тормозить дальнейшее окисление металла (см. также лекцию 4). Если объем получаемого оксида Voкс меньше объема металла Vмет (Voкс/Vмет <1), то образуется несплошная пористая пленка, обладающая низкими защитными свойствами. Если же Voкс/Vмет <1, то образуются сплошные пленки, защищающие металл от коррозии.
Наиболее высокими защитными свойствами обладает сплошная, достаточно тонкая прочная эластичная пленка, возникающая на гладкой поверхности металла, имеющая с ним хорошее сцепление и одинаковый с ним коэффициент линейного расширения. При этом пленка должна иметь некоторую оптимальную толщину, чтобы в достаточной степени тормозить встречную диффузию молекул агрессивного агента и катионов металла.
Однако на большинстве металлов защитная пленка после достижения известной толщины растрескивается, что позволяет ГК развиваться дальше. Разрушение пленки возможно по ряду причин. Если объем пленки больше объема металла, на месте которого она образовалась, то это приводит к появлению внутренних напряжений, сжимающих пленку параллельно поверхности и стремящихся оторвать ее от металла. При высоких внутренних напряжениях пленка разрушается. Таким образом, важны не только защитные свойства пленки, но и ее механические свойства - прочность, упругость и другие.
Скорость ГК зависит не только от свойств образующихся пленок, но и от ряда других внутренних и внешних факторов (см. также лекцию № 4). К внутренним факторам относятся природа металла, состав и структура сплава, степень обработки поверхности, наличие внутренних напряжений.
Так, скорость ГК сплавов на основе железа значительно снижается при содержании в них титана, меди, кобальта, бериллия, хрома, алюминия, кремния. Углерод заметного влияния не оказывает. В то же время скорость ГК значительно возрастает при содержании в сплавах ванадия, вольфрама и молибдена. В целом наименее устойчивы к действию ГК наиболее активные металлы – K, Ca, Na, Mg. Наиболее устойчивыми являются Pd, Ir, Pt, Au.
Особенно большое ускоряющее влияние на коррозию сталей оказывают соединения ванадия, в первую очередь V2O5, если они содержатся в продуктах сгорания углеводородного топлива. Оксид ванадия (V) содержится в золе, образующейся при сжигании мазута и других нефтепродуктов. При т.н. “ванадиевой коррозии” зола налипает на металл и увеличивает скорость его коррозии в десятки раз. Это обусловлено легкоплавкостью V2O5 и его способностью офлюсовывать вещества золы и окалины, т.е. переводить их в жидкое состояние. что снижает защитные свойства пленок окалины. Кроме того, Оксид ванадия (V) активно участвует в процессе окисления железа по схеме:
4Fe + 3V2O5 = 2Fe2O3 + 3 V2O3 (1)
V2O3 + O2 = V2O5 (2)
V2O5 + Fe2O3 = 2FeVO4 (3)
Атомарное железо вначале окисляется оксидом ванадия (V) до трехвалентного. Образовавшийся при этом оксид ванадия (III) легко окисляется снова до пятивалентного состояния. При высокой температуре взаимодействие оксидов ванадия (V) и железа (III) образуется ванадат железа.
Гладкие металлические поверхности подвергаются ГК несколько медленнее, при этом степень обработки поверхности влияет на скорость ГК лишь на начальной стадии окисления.
К внешним факторам ГК относятся температура, состав газовой среды, скорость движения газа, условия нагревания и т.д.
С увеличением температуры скорость ГК возрастает более значительно, чем по правилу Вант-Гоффа вследствие увеличения коэффициента диффузии и ослабления защитных свойств пленки.
Температурным влиянием на коррозию определяются такие важные свойства металлов, как жаростойкость и жаропрочность. Жаростойкость характеризует способность металла сопротивляться коррозионному воздействию газов при высокой температуре. Жаропрочность определяет способность материала в условиях высокотемпературного воздействия сохранять необходимые механические свойства, длительную прочность и сопротивление ползучести.
Так, например, жаропрочные стали можно эксплуатировать до 700 0С, алюминиевые и медные сплавы – до 400-500 0С, свинец – до 150 0С. Никель-хромовые сплавы работают до 1000 0С.
Резкие температурные изменения часто вызывают быстрое разрушение защитной пленки. Это связано прежде всего с различными коэффициентами линейного расширения металла и пленки, что способствует возникновению добавочных внутренних напряжений и механическому разрушению пленки.
Состав газовой среды во многом определяет скорость ГК. Наиболее активными газообразными окислителями являются фтор, кислород, диоксид серы, хлор, сероводород. Их активность по отношению к различным металлам не одинакова. Например, алюминий и его сплавы, хром и стали с высоким содержанием хрома устойчивы в кислородсодержащей атмосфере. Однако они становятся совершенно неустойчивыми в присутствии хлора. Никель неустойчив в атмосфере диоксида серы, тогда как медь вполне устойчива. Коррозия низколегированных и углеродистых сталей в выхлопных газах двигателей внутреннего сгорания, в топочных и печных газах сильно зависит от соотношения СО и О2. Повышение содержания О2 увеличивает скорость газовой коррозии и, наоборот, повышение содержания СО ослабляет коррозию. Ряд металлов (Со, Ni, Сu, Рb, Сd, Тi) устойчивы в атмосфере чистого водяного пара при температуре выше температуры кипения воды.
Скорость движения газа заметно влияет на скорость ГК в начальной стадии окисления.
Несмотря на обилие факторов, скорость ГК определяется прежде всего свойствами возникающей на поверхности металла защитной пленки. В свою очередь, физико-химические свойства пленок определяются природой металла и окислителя, а также температурой.
Химическая коррозия в жидких неэлектролитах.
Напомню, что неэлектролитами называются вещества, неспособные подвергаться электролитической диссоциации, поэтому их растворы и расплавы не проводят электрический ток.
КЖН металлов протекает в среде агрессивных органических жидкостей, являющихся неэлектролитами, под действием содержащихся в них окислителей. К промышленным неэлектролитам относятся органические растворители (бензол, хлороформ и др.), расплавы солей серы и других веществ, жидкое топливо (обезвоженная нефть, керосин, бензин и другие нефтепродукты), сероуглерод, жидкий бром и др. под действием. В нефтяной промышленности КЖН происходит на внутренних поверхностях нефтехранилищ, нефтепроводов, нефтехимического оборудования, бензобаков.
КЖН протекает преимущественно по химическому механизму. Данный процесс состоит из нескольких стадий, каждая из которых влияет скорость коррозии:
1) диффузия окислителя из жидкой фазы к поверхности металла;
2) хемосорбция окислителя;
3) химическая реакция между металлом и окислителем;
4) десорбция продуктов коррозии с поверхности металла;
5) диффузия продуктов коррозии в объем неэлектролита.
В некоторых случаях на металлической поверхности образуется защитная пленка, которая затрудняет диффузию окислителя к поверхности металла и тем самым тормозит коррозионного процесса.
Температура в значительной степени влияет на скорость КЖН. В ряде случаев изменение температуры приводит к изменению растворимости окислителя и пленки продуктов коррозии в неэлектролите, что неоднозначно влияет на скорость процесса.
Углеводороды и органические растворители, входящие в состав жидких топлив, сами не являются коррозионно-активными по отношению к металлам. Так, бензин прямой гонки при отсутствии воды практически не действует на технически важные металлы.
В то же время в сырой нефти и неочищенных нефтепродуктах присутствуют различные примеси, обладающие коррозионной активностью. Например, крекинг-бензин при взаимодействии с железом и другими металлами (Pb, Mg, Cu, Zn) осмоляется, при этом повышается его кислотность, что ускоряет коррозию.
Наличие воды в нефти и других неэлектролитах значительно активирует коррозионное действие примесей и вызывает интенсивную электрохимическую коррозию, т.е. в присутствии воды меняется механизм коррозионного процесса.
В присутствии кислорода или диоксида углерода, растворенных в нефти или воде, возникает соответственно кислородная или углекислотная коррозия нефтегазового оборудования и трубопроводов. Кислородная коррозия нефтепромыслового оборудования, как правило, протекает более интенсивно, чем углекислотная. В продуктивных пластах кислород не содержится, его присутствие в коррозионной среде всегда имеет техногенное происхождение. Наиболее существенный источник кислорода – вода из природных водоёмов, которая используется при заводнении пластов и обессоливании нефти. Она содержит до 7 мг/л растворённого О2., тогда как для коррозии достаточно менее 1 мг/л. В связи с этим водоводы, транспортирующие пресную воду, особенно подвержены кислородной коррозии. Кроме того, растворённый кислород значительно снижает эффективность работы ингибиторов коррозии широко применяемых на нефтяных месторождениях.
Однако наиболее высокая коррозионная активность нефти и газа обусловлена растворенными в ней сернистыми соединениями, в первую очередь, сероводорода H2S, которые вызывают один из наиболее опасных видов химической коррозии – т.н. сероводородную коррозию (СК).
Негативная роль сероводорода H2S в процессах коррозии нефтегазового оборудования и трубопроводов разнообразна:
1. При растворении в воде он образует слабую сероводородную кислоту, которая хорошо реагирует с железом, его сплавами и многими другими металлами (Cu, Ag, Pb и др.) с образованием соответствующих сульфидов:
Fe + H2S = FeS + H2
Это приводит к возникновению точечной коррозии, особенно в присутствии кислорода или диоксида углерода.
2. Образовавшиеся сульфиды образуют микрогальваническую пару с железом в составе стали, что вызывает ЭХК и приводит к быстрому разрушению технологического оборудования и трубопроводов.
3. В нефти также содержатся органические производные сероводорода – меркаптаны и тиофенолы общей формулы RSH. При взаимодействии с металлами переменной валентности они образуют соответствующие меркаптиды, тиофеноляты и элементарную серу, которые тоже коррозионно агрессивны.
4. Наиболее опасный сероводород не только изначально входит в состав нефти и газа, но и образуется в результате термического расщепления сераорганических соединений, серооксида углерода и сероуглерода. С увеличением глубины добычи происходит повышение рабочих температур, при этом выделение сероводорода растет как за счет уменьшения его растворимости, так и за счет усиления распада серосодержащих соединений.
5. Сероводородная коррозия резко ускоряется в присутствии кислорода или воды, а еще более значительно – при их одновременном присутствии, что характерно для состава сырой нефти. Коррозия при одновременном действии H2S и О2 называется сульфитно-оксидной. В присутствии оксидов ванадия СК также резко ускоряется.
6. Газообразный сероводород, особенно в составе нефтяного попутного газа, вызывает интенсивную газовую коррозию нефтегазового оборудования и трубопроводов. Этому способствуют повышенное давление в трубопроводах и даже небольшая влажность транспортируемого газа.
Сухой сероводород при комнатной температуре для углеродистых сталей не представляет опасности. Однако с повышением температуры опасность сероводородной коррозии углеродистых сталей значительно увеличивается. При температуре выше 300°С железо подвергается сильной коррозии в серосодержащих газовых средах.
В результате СК значительно сокращается срок службы силового генерационного оборудования и аппаратуры при добыче, транспорте, переработке и использовании газа. В промысловых условиях особенно большому коррозионному воздействию подвергаются трубы, задвижки, камеры сгорания и поршни силовых установок электростанций, счетчики газа, компрессоры, холодильники.
Значительная часть сероводорода реагирует с металлом и может отложиться в виде продуктов коррозии на клапанах силовых установок, компрессоров, на внутренних стенках аппаратуры, коммуникаций и магистрального газопровода.
Проблема сероводородной коррозии становится все более острой в связи с постоянным увеличении доли сернистых нефтей в общем объеме добычи как в РФ, так и во всем мире.
Дата добавления: 2015-07-11; просмотров: 78 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Упражнения для суставов Руки | | | ХРОМОСОМНАЯ ТЕОРИЯ НАСЛЕДСТВЕННОСТИ. |