
Читайте также:
|
К d-блоку относятся 32 элемента, расположенные в ПТ с N по VII период с III по V группу побочных подгрупп.
В побочных подгруппах сверху вниз увеличивается энергия ионизации, т.к. в этом направлении отмечается уменьшение радиуса, что объясняется тем, что валентные электроны уходят на предвнешний уровень => десжатие, поэтому в любой подгруппе химическая активность убывает сверху вниз. Все атомы d-элементов за исключением IIв группы имеют незавершенный электронный d-слой, этим объясняется набор разных степеней окисления d-элементов.
Общая характеристика d-элементов. Изменение химической активности d-элементов в подгруппах в направлении сверху вниз. Степень окисления, закономерности изменения кислотно-основных и окислительно-восстановительных свойств d-элементов зависимости от степени окисления. Роль d-элементов в организме. Характерные степени окисления для d-элементов, встречающихся в организме. Строение биокластеров.
К d-блоку относятся 32 элемента, расположенные в ПТ с N по VII период с III по V группу побочных подгрупп.
В побочных подгруппах сверху вниз увеличивается энергия ионизации, т.к. в этом направлении отмечается уменьшение радиуса, что объясняется тем, что валентные электроны уходят на предвнешний уровень => десжатие, поэтому в любой подгруппе химическая активность убывает сверху вниз. Все атомы d-элементов за исключением IIв группы имеют незавершенный электронный d-слой, этим объясняется набор разных степеней окисления d-элементов.
Соединения с высшей степенью окисления проявляют кислотные и окислительные свойства.
Низшая степень окисления обуславливает основные и восстановительные свойства d-элементов. Амфотерные свойства типичны для соединений с промежуточной степенью окисления.
В группах с увеличением заряда ядра увеличивается устойчивость соединений с высшей степенью окисления.
Сu – «металл жизни» микроэлемент, концентрируемый в печени, мозге, мышцах, надпочечниках.
Ag – в организме, антисептик. В медицине используют AgNO3 – ляпис – обладает вяжущим противовоспалительным и антисептическим действием
Au – противовоспалительное средство, лечит инфекционный полиартрит, туберкулез, кожные и венерические заболевания.
Zn – повышает иммунитет
Cr – регуляция синтеза жиров и обмена углеводов; влияние на усвояемость глюкозы и уровень сахара в крови; профилактика атеросклероза
Мо+6, Мо+5 – содержатся в организме, входит в состав ферментов; катализирует окисление ксантина и гипоксантина до мочевой кислоты и альдегидов.
Мn+2 – в организме образует комплекс с нуклеиновыми кислотами и аминокислотами, входит в состав ферментов, участвует в синтезе витамина С и В12
Степень окисления Сu +1,+2; Ag +1,+2; Au +3; Zn +2; Cr +2,+3,+6; Мо +6; Мn +2,+3,+4,+6,+7
Биокластеры – белковые молекулы образуют с d- элементами бионеорганические комплексы. Ион металла(металл-комплексообразователь) располагается внутри полости кластера, взаимодействуя с электроотрицательными атомами связывающих групп белка.
58. Общая характеристика d-элементов VIБ группы. Электронные формулы для хрома, молибдена, вольфрама и наиболее устойчивые их степени окисления. Характер соединений в степени окисления +2,+3,+6. Биологическая роль Cr+3, Мо+6. Ксантиоксидаза и альдегидоксидаза – ферменты, содержащие Мо+6.
(n - 1)dаnsв, где а = от 1 до 10, в = от1 до 2
Для стабилизации d-структуры у Сr Мо наблюдается «проявление» электронов на d-подуровне.
Сr: …3d54s1 +2,+3,+6 Мо: …5d46s2 +6 W: …5d46s2 +6
По группе сверху вниз: радиус уменьшается; энергия ионизации увеличивается; химическая активность уменьшается.
В низшей степени окисления – основные и восстановительные свойства Сr образует CrO, Cr(OH)2
В промежуточной степени окисления – амфотерные свойства Cr2O3 ему соответствуют Cr(OH)3, Н3СrО3 – ортохромистая кислота; НСrО2 – метахромистая кислота.
В высшей степени окисления кислотные и окислительные свойства CrО3.
Cr – регуляция синтеза жиров и обмена углеводов; влияние на усвояемость глюкозы и уровень сахара в крови; профилактика атеросклероза.
Мо+6, Мо+5 – содержатся в организме, входит в состав ферментов: ксантидегидрогенеза и ксантиоксидаза(КОКС); катализирует окисление ксантина и гипоксантина до мочевой кислоты и альдегидов.
R – СООН + КОКС* Мо+6 + Н2О 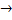 Н3О…ОСR – КОКС*Мо+4
Н3О…ОСR – КОКС*Мо+4 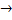
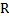 ООН + КОКС*Мо+6 + 2Н+
ООН + КОКС*Мо+6 + 2Н+
59. Общая характеристика элементов VII Б группы. Электронные формулы для марганца, технеция, рения. Наиболее устойчивые степени окисления для них. Изменение химической активности в ряду указанных элементов. Соединения марганца в степени окисления +2,+4,+6,+7. Окислительная активность перманганат- иона в зависимости от среды. Биологическая роль Мn+2 и соединения марганца, применяемые в медицине.
Mn: …3d54s2 +2,+3,+4,+6,+7 Те: …4d55s2 +4,+7 Rе: …5d56s2 +4,+7
Mn+2: MnO, Mn(OH)2, [Mn(H2O)4]CI2
Mn+4: MnO2, Mn(OH)4 – амфотерное; ОВ двойственность: Н4МnО4 и Н2МnО3 орто- и метамарганцеватистая
Mn+6: MnO3, Н2МnО4 – марганцеватистая; К2 МnО4 – манганат, неустойчивый окислитель
Mn+7: Mn2O7, НМnО4 – марганцовая; КМnО4 – перманганат калия, сильный окислитель.
Мn+2 – в организме образует комплекс с нуклеиновыми кислотами и аминокислотами, входит в состав ферментов, участвует в синтезе витамина С и В12; содержится в красной свекле, картофеле, печени.
КМnО4 – 5% дезинфицирующее, кровоостанавливающее, противоожоговое действие
MnSO4 – лечение анемии
MnCI2 – лечение атеросклероза
60. Элементы VIII группы. Семейство железа. Характерные степени окисления +2,+3,+6. Характерные комплексные соединения для Fe+2, Fe+3. Биологическая роль Fe+2, Fe+3 и Со+2. Препараты железа, используемые в медицине. Общая характеристика d-элементов I Б группы. Электронные формулы и степени окисления меди, серебра и золота. Координационные числа, тип гибридизации атомных орбиталей, структура соединений. Отношение этих элементов к кислотам, кислороду и сере. Биологическая роль Сu+2. Оксигеназы и гидроксилазы. Церуллоплазмин. Их роль в биохимических процессах.
Общая характеристика элементов I Б группы:
электронная формула: (n - 1)d9s2 для стабилизации – «провал» электронов (n - 1)d10s1
Сu: …3d104s1 +1,+2 Ag: …4d105s1 +1,+2 Аu: …5d106s1 +3
Эти элементы образуют комплексные соединения с координационным числом =2 и 4, что соответствует sp и sp3 гибридизации.
CuCI2 + 2NH3 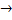 [Cu(NH₃)₂]CI
[Cu(NH₃)₂]CI
Au(OH)₃ + NaOH 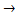 Na[Au(OH)₄]
Na[Au(OH)₄]
Cu, Au, Ag – малоактивные металлы
Cu, Ag – взаимодействуют с концентрированными HNO₃, H₂SO₄
Au – растворяется в «царской водке»
Сu – «металл жизни» микроэлемент, концентрируемый в печени, мозге, мышцах, надпочечниках, содержится более, чем в 25 ферментах – оксигеназы(Е1) и гидроксилазы(Е)
Ионы Cu содержится в белке церуллоплазмине, он катализирует окисление Fe+2 до Fe+3. Связывает Cu+2 и транспортирует по организму.
61. Характеристика d-элементов II Б группы. Электронные формулы для цинка, кадмия и ртути. Характерные степени окисления. Изменение кислотно-основных свойств от цинка к ртути. Строение комплексных соединений. Гидроксиды данных элементов и их свойства. Биологическая роль Zn+2. Карбоангидраза, строение активного центра металлофермента, биологическая роль. Карбопепсидаза. Механизм участия карбопепсидазы в реакциях гидролиза пептидных связей. Токсическое действие на организм Hg+2, Cd+2. Соединения цинка и ртути, применяемые в медицине.
Zn: … 3d104s2 +2 Cd: …4d105s2 +2 Hg: …5d106s2 +1,+2
По группе сверху вниз
Радиус уменьшается; восстановительные свойства уменьшаются; основные свойства уменьшаются
Zn – амфотерный металл, склонен к комплексообразованию с координационным числом =7, 4 и 6.
Амфотерные свойства оксида цинка: ZnО + 2НСl + 3Н2О 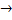 [Zn(H₂O)₄]Cl ZnО + 2NaOH + Н2О
[Zn(H₂O)₄]Cl ZnО + 2NaOH + Н2О 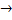 Na₂[Zn(OH)₄]
Na₂[Zn(OH)₄]
Амфотерные свойства Cd(OH)₂: Cd(OH)₂ + 6NH₃ 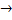 [Cd(NH₃)₆](OH)₂ Cd(OH)₂ + 2НСl
[Cd(NH₃)₆](OH)₂ Cd(OH)₂ + 2НСl 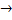 CdCl₂ + 2H₂O
CdCl₂ + 2H₂O
Zn – повышает иммунитет. Карбоангидраза – катализирует обратимую гидратацию CO₂, отвечает за углеводный обмен. Карбоксипептидаза – катализирует процесс гидролиза пептидных связей.
 О О
О О
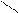
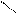 R₁ - C + Н₂O
R₁ - C + Н₂O 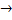 КОП Zn R₁ - С + R₂ - NH₂
КОП Zn R₁ - С + R₂ - NH₂
NH ОН
l
R₂
HgCl – сильный яд: дезинфицирующее средство, дубление кожи
62. Общая характеристика р-элементов, их расположение в периодической системе элементов. Строение электронных уровней для р-элементов. Характер изменения свойств р-элементов по периодам и подгруппам. Наиболее характерные степени окисления. Правило «четности». Органогенные р-элементы. Микроэлементы среди р-семейства.
30 элементов, lllа – Vll, находятся во ll и lll малых периодах, lV – Vl больших периодов. У р-элементов валентными являются s и p электроны внешнего уровня, число их равно номеру группы.
Общее электронное строение: ns²npа, а = от 1 до 6.
При движении в периодах слева на право: атомные радиусы уменьшаются; величина энергия ионизации возрастает – приводит к нарастанию неметаллических и окислительных свойств
В главных подгруппах сверху вниз в связи с ростом радиуса величина энергии ионизации уменьшается т.е. металлические и восстановительные свойства возрастают.
р-элементы проявляют положительную степень окисления = номеру группы. Для р-элементов выполняется правило «четности»: элементы не четных групп проявляют нечетную степень окисления, а элементы четных групп проявляют четную степень окисления.
Р-элементы начиная с lVА группы проявляют отрицательную степень окисления(номер группы - 8)
При переходе вниз по группе устойчивость максимальной положительной степени окисления уменьшается и возрастает устойчивость низших степеней окисления.
Органогенные р-элементы: С, N, P, O, S
Микроэлементы среди р-семейства: Аs, Se
63. Свойства р-элементов III А группы. Изменение активности в подгруппе. Борные кислоты. Бура. Амфотерный характер алюминия, оксида и гидроксида алюминия. Соединения, характерные для таллия. Биологическая роль AI+3 и его соединений, применяемых в медицине.
В: …2s²2p¹ +3 AI: …3s²3p¹ +3 Ga: …4s²3d¹⁰4p¹ +3 In: …5s²4d¹⁰5p¹ +3 Tl: …6s²4f¹⁴5d¹⁰6p¹ +3, +1
В2О3 + Н2О 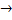 2НВО2 – метаборная
2НВО2 – метаборная
В2О3 + 3Н2О 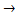 2Н3ВО3 – ортоборная
2Н3ВО3 – ортоборная
2В2О3 + Н2О 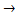 Н2В4О7 - тетраборная
Н2В4О7 - тетраборная
4 Н3ВО3 + 2NaOH = Na₂B₄O₇ + 7H₂O Бура
AI – типичный амфотерный элемент
AI₂O₃, AI(OH)₃ - амфотерные свойства
Металлические свойства AI выражены сильнее, чем у В
2AI + 6HCl + 12H₂O 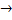 2[Al(H₂O)₆]Cl₃ + 3H₂ - основные свойства
2[Al(H₂O)₆]Cl₃ + 3H₂ - основные свойства
2Al + 6NaOH + 6H₂O 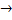 2Na₃[Al(OH)₃] + 3Н₂ - кислотные свойства
2Na₃[Al(OH)₃] + 3Н₂ - кислотные свойства
Al+3 – входит в состав ферментов; недостаток приводит к недостатку витамина В1; избыток тормозит синтез гемоглобина. Фармакологическое действие солей Al основано на том, что Al+3 образуют с белками комплексы, выпадающие в виде гелей, препятствует проникновению микроорганизмам, снижает воспалительную реакцию.
KAl(SO₄)₂*12H₂O – для промывания ран, примочек, спринцеваний при воспалительных заболеваниях слизистых оболочек.
(CH₃COO)₃Al – 8% раствор – жидкость Бурова, вяжущее и противовоспалительное действие
Al₂O₃*SiO₂*H₂O – белая глина, в стоматологии – состав пломбировочного материала
Свойства р-элементов lV А группы. Электронные формулы и степени окисления для углерода, кремния, германия, олова и свинца. Изменение химической активности в подгруппе, кислотно-основных и окислительно-восстановительных свойств соединений данных элементов. Оксиды р-элементов lV А группы и соответствующие им кислоты. Угольная, кремневая, поликремневая, оловянная, свинцовая кислота. Токсическое действие на организм свинца и его соединений.
С: …2s²2p² +2, +4, -4 Si: …3s²3p² +4,-4 - неметаллы
Ge: …4s²3d¹⁰4p² +4,+2 Sn: …5s²4d¹⁰5p² +4,+2 - амфотерные
Pb: …6s²4f¹⁴5d¹⁰6p² +4,+2 - типичный металл
СО2
SiO₂ - H₂SiO₃ - все кремневые кислоты очень слабые, растворимые в воде силикаты подвержены гидролизу
SnO₂ – H₂SnO₃
PbO₂ - H₂PbO₃
Pb попадая в организм с пищей, воздухом, водой Pb депонирует в скелете. Pb взаимодействует и блокирует sh-группы белков в молекулах ферментов образуется альбуминат свинца. Альбуминаты не способны участвовать в биохимических процессах. Pb+2 вытесняет естественные ионы металлов, ингибируя активность фермента.
65. Свойства р-элементов V А группы. Электронные формулы, характерные степени окисления. Закономерности изменения свойств элементов в подгруппе. Фосфор, кислородные соединения, соответствующие им кислоты. Свойства солей. Окислительно-восстановительная активность Р+5, Р+3 и Р-3. Состав и биологическая роль АТФ и АДФ.
N: …2s²2p³ +5,+3,-3,-2,-1,0,+1,+2,+4 Р: …3s²3p³ +5,+3,-3 Аs: …4s²3d¹⁰4p³ +5,+3,-3 Sb:...5s²4d¹⁰5p³ +5,+3
Bi: …6s²4f¹⁴5d¹⁰6p³ +5, +3 – типичный металл
Р- существует в нескольких аллотропных модификаций. Наиболее изучен белый и красный фосфор.
Р+3 – окислитель и восстановитель
Р2О3 + 3Н2О = 2Н3РО3 фосфористая кислота(фосфиты)
Р+5 – окислитель
Р2О5 + 3Н2О = 2Н3РО4 фосфорная кислота
Р2О5 + 2Н2О = Н4Р2О7 пирофосфорная
АТФ и АДФ – производные ди- и трифосфорных кислот
АТФ – бионеорганическое соединение, т.к. состоит из органической части – аденозина и неорганической – трех связанных в цепь фосфатных групп.
АДФ - бионеорганическое соединение, т.к. состоит из органической части – аденозина и неорганической – двух связанных в цепь фосфатных групп.
АТФ функционирует в клетке как промежуточный продукт, переносящий энергию и сопрягающий реакции, сопровождающиеся выделением и потреблением энергии.
66. Мышьяк, сурьма и висмут. Характерные степени окисления для мышьяка, сурьмы и висмута. Оксиды их кислотно-основный характер. Кислоты и соли мышьяка, сурьмы. Мышьяковистая и мышьяковая кислоты. Арсениты и арсенаты. Токсическое действие As+3. Биологическое действие As+5. Реакция Марша.
Аs: …4s²3d¹⁰4p³ +5,+3,-3 Sb:...5s²4d¹⁰5p³ +5,+3 Bi: …6s²4f¹⁴5d¹⁰6p³ +5, +3
As₂O₃ - амфотерный
Н₃AsO₃ - мышьяковистая кислота
As₂O₅ - кислотный
H₃AsO₄ - мышьяковая кислота
Арсениты и арсенаты – соли мышьяка.
Соединения As+5, As+3 очень токсичны(легко вступают в реакцию с белками)
As – накапливается в ногтях и волосах
Определение мышьяка в биологическом материале приводит в приборе по реакции Марша: 2AsH₃ = 2As + 3Н2
На стенке прибора образуется «мышьяковое зеркало» - качественная реакции
Свойства р-элементов VI А группы. Электронные формулы и степени окисления. Степени окисления для кислорода. Активные формы кислорода, механизм действия на организм, ферментная антиоксидантная защита. Устойчивость водородных соединений элементов VI А группы. Окислительно-восстановительный характер соединений элементов данной группы.
О: …2s²2p⁶ -2,+2 S: …3s²3p⁴ -2,+2,+4,+6 Se: …4s²3d¹⁰4p⁴ -2,+4,+6 Те: …5s²4d¹⁰5p⁴ -2,+4,+6 Po: …6s²4f¹⁴5d¹⁰6p⁴
Активные формы О:
О2 + ē 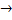 О2º (супероксидный анион)
О2º (супероксидный анион)
О2º + О2º + 2Н+ 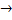 Н2О2 + О2
Н2О2 + О2
Н2О2 + О2º 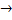 2ОН⁰ + О2
2ОН⁰ + О2
ОН⁰ + О2º 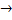 О2* + ОН-
О2* + ОН-
О – состав всех биологических объектов
Н2О2 + Fe+2 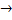 Fe+3 + ОН- + ОН. – реакция Фентона
Fe+3 + ОН- + ОН. – реакция Фентона
С увеличением радиусов ионов Э-2 и соответствующим ослаблением связей Э – Н. в том же направлении растет восстановительная способность Н2Э. в водных растворах Н2Э проявляют слабокислые свойства. Кислоты Н2ЭО3 в свободном состоянии неустойчивы. Соли этих кислот и сами кислоты проявляют окислительно-восстановительную двойственность. Кислоты состава Н2ЭО4 более устойчивы и в реакциях ведут себя как окислители.
68. Свойства серы и её соединений. Действие тяжелых металлов на серосодержащие ферменты. Свойства сероводорода, его токсичность. Сернистая, серная и тиосерная кислоты. Их соли. Оксиды и кислоты селена и теллура.
S – типичный неметалл; входит в состав аминокислот и белков; меркаптогруппа
Na₂S₂O₃*5H₂O – тиосульфат натрия – противовоспалительное, противотоксическое действие
Ионы тяжелых металлов, попадающие в организм, образуют плохо растворимые сульфиты.
CN- взаимодействуя с серой образует менее токсичные тиоционаты.
H₂S – бесцветный газ с неприятным запахом. Весьма токсичное вещество, т.к. является ингибитором фермента цитохромоксидазы. Он блокирует перенос электронов с цитохромидазы на кислород.
При растворении SO₂ в воде образуется сернистая кислота H₂SO₃. Кислота образует соли двух типов: средние – сульфиты(Na₂SO₃) и кислые – водородсульфиты(NaHSO₃). SO₂ - газ с удушливым запахом, весьма ядовит.
Серная кислота H₂SO₄. Атмосферная влага с растворенными SO₂ и H₂SO₄ выпадает в виде кислотных дождейю
Тиосерная кислота H₂S₂O₃. Соль тиосерной кислоты натрий тиосульфат Na₂SO₃ - противотоксическое противовоспалительное действие.
SeO₃ и TeO₃ - кислотные оксиды. Селеновая кислота H₂SeO₄ и теллуровая H₂TeO₄ - кристаллические вещества с сильными окислительными свойствами.
Галогены. Электронные формулы. Степени окисления. Изменение химической активности в подгруппе. Водородные соединения галогенов. Хлорная вода. Жавелевая вода. Хлорная известь. Кислородные соединения хлора. Биологическая роль галогенов и применение их соединений в медицине.
F: …2s²2p⁵ -1 Cl: …3s²3p⁵ -1,+1,+3,+5,+7 Br: …4s²3d¹⁰4p⁵ -1,+1,+3,+5,+7 I: …5s²4d¹⁰5p⁵ -1,+1,+3,+5
Окислительные свойства от F к l уменьшаются. Водные растворы галогенидов образуют кислоты.
HF<HCl<HBr<HI → кислотность возрастает.
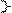 Cl₂ + H₂O
Cl₂ + H₂O 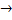 HCI + HCIO хлорная вода
HCI + HCIO хлорная вода
HCI+HCIO+2KOH=KCI+KCIO+2H₂O – жавелевая вода
2Ca(OH)₂+2CI₂=Ca(CIO)₂+2H₂O+CaCI₂ - хлорная известь
NaF – употребляют в качестве местного действующего наружного средства(зубная паста)
I₂ - в виде 5% раствора спиртового для стерилизации ран
NaI – для лечения зоба, щитовидной железы
KI – для лечения глазных заболеваний
CI₂ - обеззараживание питьевой воды
HCI- внутрь при недостаточной кислотности желудочного сока
NaBr – успокаивающее средство при нервных расстройствах
Физикохимия поверхностных явлений. Поверхностное натяжение и поверхностная энергия. Способы снижения поверхностного натяжения. Поверхностно-активные вещества, их строение. Поверхностная активность, изменение ее от природы растворенного вещества. Изотермы поверхностного натяжения. Правило Дюкло-Траубе. Применение ПАВ в медицине.
Живые организмы – системы с очень разными поверхностями раздела, к которым относят: кожные покровы, поверхность стенок кровеносных сосудов, слизистые оболочки, клеточные мембраны, мембраны ядер.
Поверхностное натяжение – сила, действующая на единицу длины границы раздела и обуславливающая сокращение поверхности жидкости ( ). Поверхностное натяжение можно уменьшить путем введения поверхностно-активных веществ и повышением температуры.
). Поверхностное натяжение можно уменьшить путем введения поверхностно-активных веществ и повышением температуры.
Величина поверхностной энергии равна произведению поверхностного натяжения на величину всей поверхностности.
Поверхностно-активные вещества – вещества, уменьшающие поверхностное натяжение на границе раздела жидкость газ. Гидрофильный момент молекулы склонны растворять в воде, полярная головка содержит длинный углеводородный хвост, имеющий гидрофобные свойства. В связи с особенностью своего строения соединения обладают дифильными свойствами.
Поверхностная активность – способность растворимых веществ изменять поверхностное натяжение растворителя.
Изменение её от природы растворенного вещества:
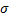 р-р <
р-р < 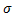 о). ПАВ, g>0.
о). ПАВ, g>0. р-р >
р-р > 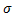 о).
о). Поверхносто-инактивные вещества(ПИВ), g<0.
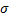 р-р =
р-р = 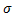 о). поверхностно-неактивные вещества(ПНВ)
о). поверхностно-неактивные вещества(ПНВ)Изотермы поверхностного натяжения – зависимость поверхностного натяжения при постоянной температуре от концентрации растворенного вещества.

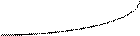
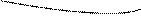

ПИВ
ПНВ
ПАВ
Правило Дюкло-Траубе: поверхностная активность вещества одного и того же гомологичного ряда возрастает в 3раза, при удлинении углеродной цепи на одну группу СН2 –
ПАВы применяются в хирургии, в качестве антисептических средств, в 300раз эффективнее фенола по губительному действию.
Адсорбция. Понятие адсорбента и адсорбтива. Адсорбционная система типа жидкость-жидкость. Уравнение Гиббса для расчета адсорбции, его анализ. Изотерма адсорбции. Строение адсорбционного слоя.
Адсорбция(Г) – самопроизвольные изменения концентрации растворенного вещества на границе раздела фаз.
Г=  *
* 
Адсорбент – вещество способное поглощать, т.е. адсорбировать другое вещество на своей поверхности.
Адсорбтив – адсорбируемое вещество.
Анализ уравнения Гиббса:
 <0, Г>0
<0, Г>0
 >0, Г<0
>0, Г<0
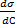 =0, Г=0
=0, Г=0Изотерма адсорбции – зависимость адсорбции от концентрации ПАВ
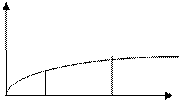 |
I II III
При адсорбции полярная группа втягивается в воду в то время, как на полярный радикал выталкивается в неполярную фазу. При малых концентрациях углеводородные радикалы могут располагаться:
С ростом концентрации в растворе число молекул в поверхностном слое увеличивается. Неполярные цепи поднимаются и принимают вертикальное положение.
Адсорбция на неподвижных поверхностях раздела. Адсорбция и хемосорбция, их особенности. Природа адсорбента. Теория Лэнгмюра для описания хода изотермы адсорбции. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применение ионитов в медицине.
Иониты применяются для обессаливания воды, в ионно-обменной хроматографии, для выделения и очистки аминокислот, для консервирования крови.
Существование минимального значения поверхности натяжения у растворов ПАВ и предельного значения адсорбции позволили Лэнгмюру высказать предположение об ориентации адсорбированных молекул в поверхностном слое. При адсорбции полярная группа втягивается в воду в то время, как на полярный радикал выталкивается в неполярную фазу. При малых концентрациях углеводородные радикалы могут располагаться:
С ростом концентрации в растворе число молекул в поверхностном слое увеличивается. Неполярные цепи поднимаются и принимают вертикальное положение.
Механизм молекулярной адсорбции лежит в основе современных методов лечения гемосорбции(очистка крови от токсичных веществ с помощью различных адсорбентов). Применяется при почечной недостаточности, ри сильных отравлениях снотворными и фосфорорганическими соединениями.
Дата добавления: 2015-07-11; просмотров: 254 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни. | | | Понятие инноваций и инновационной деятельности в бизнесе. Актуальные инновационные направления в научном обеспечении туристско-рекреационной деятельности |