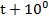Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
Применение второго начала ТД к живым организмам. Математическое выражение 2 начала ТД для открытых систем. | Энергия Гиббса как функция состояния системы и критерий направленности процесса. | Закон действующих масс для химического равновесия. Константа химического равновесия, способы ее выражения. Прогнозирование смещения химического равновесия. | Понятие о стационарном состоянии живого организма, его характеристики. Сходство и отличие стационарного состояния от химического равновесия. Гомеостаз и адаптация организма. | Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр. | Законы Генри, Дальтона, Сеченова. Применение этих законов при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови. | Повышение температуры кипения растворов. | Буферная емкость. Влияние добавления или щелочи на pH среды буферных систем. Буферная емкость по кислоте(Ва) и по щелочи(Вв). Факторы, определяющие буферную емкость. | Буферные системы крови. Бикарбонатная, фосфатная, белковая и гемоглобиновая буферные системы. Их состав, механизм действия в присутствии кислот и щелочей. | Нарушение кислотно-щелочного равновесия. Ацидоз, алкалоз. Способы их устранения. |
1879г. – Вант-Гофф установил, что при повышении температуры на 10⁰С скорость гомогенной химической реакции увеличивается в 2 – 4 раза.
Vt2 = Vt1  kt2 = kt1
kt2 = kt1 
 – температурный коэффициент константы скорости реакции (2 – 4)
– температурный коэффициент константы скорости реакции (2 – 4)
 =
= 
 =
= 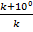
Vt, kt - скорость и константа при температуре  и
и  - при
- при 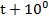
Дата добавления: 2015-07-11; просмотров: 246 | Нарушение авторских прав
mybiblioteka.su - 2015-2025 год. (0.007 сек.)

 kt2 = kt1
kt2 = kt1 
 – температурный коэффициент константы скорости реакции (2 – 4)
– температурный коэффициент константы скорости реакции (2 – 4) =
= 
 =
= 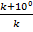
 и
и  - при
- при