
Читайте также:
|
При различных заболеваниях наблюдается смещение pH. При смещении pH крови в кислую область от нормы – ацидоз. В щелочную – алкалоз.
Ряд патологических состояний характеризуется ацидозом, наблюдается при ИБР, сахарном диабете, заболеваниях желудка. Алкалоз при заболеваниях печени.
Длительное смещение pH крови на 0,2, 0,3 приводит к смерти больного.
При ацидозе в организм вводят стерильный раствор NaHCO3 4%, а при алкалозе вводят внутривенно раствор аскорбиновой кислоты.
37. Понятие о кислотно-основном состоянии организм. Гидролиз солей разного типа: образованных сильной кислотой и слабым основанием, сильным основанием и слабой кислотой и солей, образованных слабыми кислотами и основаниями. Примеры. Константа гидролиза. Степень гидролиза. Роль реакций гидролиза в биохимических процессах. Гидролиз АТФ.
Кислотно-основное состояние определяется соотношением кислот и оснований во внутренней среде организма.
Гидролиз соли – взаимодействие соли с молекулами воды, приводящее к образованию малодиссоциированных соединений.
1. Соли, образованные сильной кислотой и слабым основанием:
NH4Cl + HOH = NH3*H2O + HCl
NH3+ + HOH = NH3 + H3O+ (pH<7)
2. Соли, образованные слабой кислотой и сильным основанием:
CH3COONa + HOH = CH3COOH + NaOH
CH3COO- + HOH = CH3COOH + OH- (pH>7)
3. Соли, образованные слабой кислотой и слабым основанием:
NH4CN + HOH = NH3*H2O + HCN
NH4+ + CN- + HOH = NH3*H2O + HCN
Количественно гидролиз как КО-равновесие характеризуется степенью гидролиза αг и константой гидролиза Кг.
Степень гидролиза измеряется отношением количества гидролизованного вещества к общему количеству растворенного вещества: αг = 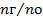 (доли или %)
(доли или %)
nг – количество гидролизованной соли
nо – общее количество растворенной соли
Константа гидролиза – концентрация недиссоциированных молекул воды в разбавленных расворах практически постоянна при Т= const, произведение Кс[Н2О] поэтому также будет величиной постоянной.
Кс[Н2О] = 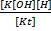 = Kг
= Kг
Ферментативный гидролиз, благодаря ему три основных компонента пищи – жиры, белки и углеводы – в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты.
Гидролиз АТФ: АТФ4- + Н2О = АДФ3- + НРО42- + Н+
АТФ функционирует в клетке как промежуточный продукт, переносящий энергию и сопрягающий реакции, сопровождающиеся выделением и потреблением энергии. Промежуточное значение свободной энергии гидролиза АТФ очень важно для его биологической функции и делает это соединение незаменимым переносчиком энергии, обеспечивающим круговорот энергии в клетке.
Предмет и основные понятия химической кинетики. Роль кинетики в решении медико-биологических проблем. Скорость химической реакции. Средняя и истинная скорость. Единицы измерения. Способы определения скорости реакции.
Химическая кинетика – учение о скоростях химических реакций их механизме и закономерностях протекания во времени.
В биологических процессах важным является замедление процесса – ингибирование.
Простые реакции – продукт образуется в результате непосредственного взаимодействия молекул реагентов.
Сложные реакции – конечный продукт получается в результате осуществления двух и более простых реакций.
Скорость химической реакции – показывает изменение концентраций реагирующих веществ в единицу времени в единице реакционного пространства.
В химической кинетике пользуются понятием средней скорости: Vср = ± 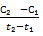 = ±
= ± 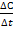
С₂, С₁ - конечная и начальная концентрации
t₂, t₁ - разность времени
[моль/л*мин], [моль/л*с], [моль/л*сут]
В ходе реакции её скорость меняется непрерывно, поэтому поэтому лучше пользоваться истинной скоростью: Vср = ± 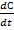
- изменение концентрации за бесконечно малый промежуток времени.
Способы определения скорости реакции:
- производят наблюдения за изменением концентрации исходных веществ или накоплением их продуктов взаимодействия.
Химические, физические и биохимические методы.
Измерить скорость реакции можно найдя концентрации реагирующих веществ в разные моменты времени с помощью химического анализа. Очень трудоемкая работа, поэтому чаще определяют какую-либо физико-химическую величину в зависимости от концентрации, затем строят график:


 Калибровочный график
Калибровочный график
В современной кинетике широко применяются физические методы, относящиеся к спектральным (поглощение световой энергии пропорциональной количеству вещества в системе).
Метод электронного парамагнитного резонанса(ЭПР) и ядерного магнитного резонанса(ЯМР)
Дата добавления: 2015-07-11; просмотров: 211 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Буферные системы крови. Бикарбонатная, фосфатная, белковая и гемоглобиновая буферные системы. Их состав, механизм действия в присутствии кислот и щелочей. | | | Влияние концентрации на скорость химической реакции. Закон действующих масс. |