
|
Читайте также: |
Фермент – белковый катализатор, способный специфически активировать субстрат.
Субстрат – вещество, которое специфически активируется данным ферментом.
Ферментативный катализ:
1. Чрезвычайная высокая эффективность:
По своей эффективности биологические катализаторы превосходят в млн раз эффективнее химических катализаторов. 2Н2О2 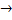 2Н2О + О2 Еа = 75кДж/моль
2Н2О + О2 Еа = 75кДж/моль
2Н2О2 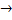 каталаза 2Н2О + О2 Еа – 23кДж/моль
каталаза 2Н2О + О2 Еа – 23кДж/моль
Такое снижение Еа приводит к увеличению скорости в 3*1011раз
2. Высокая избирательность
Каждый фермент действует на строго определенную реакцию или группы реакций – субстратная и групповая специфичность.
Субстратная специфичность включает в себя стериоспецифичность, т.е. проявление каталитической активности только в отношении одного из стериоизомеров.
Ферменты с групповой специфичностью обеспечивают превращение разных субстратов, имеющих определенные структурные фрагменты
Пример: пищеварительные ферменты(пепсин, трипсин) расщепляют пептидные связи самых разных белков
3. Ферменты проявляют свою активность в строго определенных значениях рН – среды
Пример: пепсин работает при значениях рН 1,5 – 3,5
4. Ферменты имеют температурный оптимум (35 - 40)⁰С
Если температура превышает эти пределы, активность фермента быстро снижается.
Уравнение Михаэлиса-Ментена: Vст = 
Vmax – max скорость реакции в условиях насыщения фермента
Kmax – константа Михаэлиса
[S] – концентрации субстрата
Дата добавления: 2015-07-11; просмотров: 270 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Понятие о теории переходного состояния. Катализ и катализаторы. Механизм действия гомогенного катализа. | | | Комплексные соединения. Состав и строение, исходя из теории лигандообменных равновесий А. Вернера. |