
Читайте также:
|
Энергия активации затрачивается на ослабление связей между атомами исходных веществ при этом вещества переходят в устойчивые состояния – активированный комплекс.
Н I Н  Н Н – I - старые связи не разорвались, а новые не образовались
Н Н – I - старые связи не разорвались, а новые не образовались
I + I 
Н I Н  Н Н – I
Н Н – I
Исходные активированный продукты
вещества комплекс реакции
Катализ – изменение скорости реакции с помощью катализатора.
Катализаторы – вещества, изменяющие скорость реакции и остающиеся после химической реакции в неизменном количестве и качестве.
Катализ:
1. Положительный – при добавлении катализатора в смесь скорость реакции увеличивается
2. Отрицательный – скорость реакции уменьшается
Иногда катализатор образуется в ходе химической реакции – автокаталитические реакции (явление автокатализа)
Катализ:
1. Гомогенный – если реагирующие вещества и катализатор находятся в одной фазе
2SO2 г + О2 г 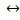 2SО3 г катализаторы: NO, NO2
2SО3 г катализаторы: NO, NO2
2. Гетерогенный – если реагирующие вещества и катализатор находятся в различных фазах
45. Биологические катализаторы – ферменты. Особенности ферментативного катализа. Уравнение
Дата добавления: 2015-07-11; просмотров: 204 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Теория активных соударений Аррениуса. Энергия активации. Уравнение Аррениуса в экспоненциальном и дифференциальном виде. Связь величины энергии активации со скоростью реакции. | | | Михаэлиса - Ментен и его анализ. |