
Читайте также:
|
Многие органические и неорганические соединения обладают способностью к свечению (люминесценции) в ультрафиолетовой и видимой области спектра. Сущность этого явления состоит в том, что будучи возбужденными, т.е. переведенными тем или иным путем в возбужденное электронное состояние, молекулы этих веществ испускают приобретенную энергию в виде квантов света (люминесценции). Люминесценция может возникать как следствие разнообразных процессов:
оптического возбуждения – фотолюминесценция,
химической реакции – хемилюминесценция,
электрохимической реакции – электрохемилюминесценция,
трения – триболюминесценция,
воздействия электрических полей – электролюминесценция,
воздействия рентгеновского излучения – ретгенолюминесценция и др.
Наиболее распространенным и изученным видом люминесценции является фотолюминесценция, которая в свою очередь подразделяется на флуоресценцию и фосфоресценцию в зависимости от природы уровня, являющегося исходным для переходов с испусканием.
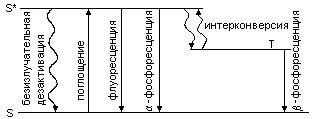
Как правило, основное состояние молекул является синглетным (S), вследствие чего переход S* ® S (S* - первое возбужденное синглетное состояние) характеризуется высокой вероятностью (флуоресценция). Фосфоресценция возникает в результате переходов T ® S (Т –нижнее триплетное состояние), запрещенных по мультиплетности и характеризуемых весьма малой вероятностью (большой длительностью свечения).
2. Важнейшей характеристикой фотолюминесценции является квантовый выход свечения В, представляющий собой отношение числа квантов Nизл, испущенных веществом в единицу времени к числу квантов возбуждающего света Nпогл, поглощенных этим веществом за то же время. Можно показать, что:
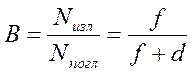
где f и d вероятность соответственно излучательных (флуоресценция) и безизлучательных (дезактивация) переходов.
Опыт показывает, что в газовой фазе квантовый выход зависит от частоты возбуждающего света nпогл, тогда как в растворе такая зависимость отсутствует. Объясняется это тем, что вероятность безизлучательной дезактивации d является функцией от избытка колебательной энергии Екол, который молекула, в соответствии с принципом Франка-Кондона обычно приобретает в результате ее оптического возбуждения. В газовой фазе молекула сохраняет приобретенную энергию вплоть до излучения, поскольку за время 10-8 – 10-9 сек она, как правило, не успевает столкнуться с другими частицами, вследствие чего d = d(Екол) = d(nпогл).
В растворе, за счет сильного взаимодействия с растворителем, избыток колебательной энергии весьма быстро передается окружающей среде, благодаря чему, исходный для излучения колебательный уровень не зависит от nпогл, а следовательно d ¹ d(nпогл). Другой важной характеристикой процесса люминесценции является длительность возбужденного состояния t’f. Если принять во внимание наряду с процессами испускания и безизлучательные переходы, характеризуемые вероятностью d, то выражение для t’f примет вид:
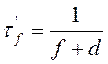 , откуда
, откуда 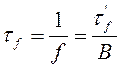 .
.
К настоящему времени установлен ряд спектральных закономерностей флуоресценции, основными из которых являются закон Стокса, правило зеркальной симметрии и универсальное соотношение между спектрами поглощения и испускания.. В соответствии с законом Стокса, центр тяжести спектра флуоресценции всегда лежит в более длинноволновой области, чем центр тяжести спектра поглощения, т.е. λфлуор >λпогл,
а νпогл >νфлуор.
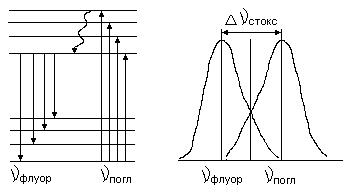
Правило зеркальной симметрии выражает тот факт, что спектры поглощения и флуоресценции симметричны относительно прямой, проходящей через точку их пересечения. В основе этого правила лежит часто наблюдающаяся на практике близость структуры и взаимного расположения колебательных подуровней основного и первого возбужденного электронных состояний молекул, а также, практически одинаковый характер относительного изменения вероятностей переходов в пределах полос поглощения и флуоресценции. Наконец, универсальное соотношение, записываемое обычно в форме:
Wфлуор(ν) = С(Т)К(ν)exp(-hν/kT), где Wфлуор(ν) – мощность флуоресценции,
К(ν) – коэффициент поглощения,
T – абсолютная температура,
позволяет расчетным путем получать спектр излучения, если известен спектр поглощения, и наоборот. Это соотношение, выведенное при условии, что возбужденная молекула по всем степеням свободы (кроме электронного движения) находится в равновесии с окружающей средой, выполняется во многих случаях, однако, далеко не всегда (значительные нарушения этого соотношения имеют место в вязких и замороженных растворах). Интенсивность люминесценции пропорциональна числу излучающих частиц, что при концентрации выраженной в моль/л можно отобразить формулой
Iл = kС.
Линеная зависимость интенсивности люминесценции от концентрации будет соблюдаться при постоянстве таких факторов, как квантовый выход, интенсивность возбуждающего света и т.д. Также существенным является условие низкой концентрации люминесцирующего вещества.
С увеличением концентрации зависимость интенсивности люминесценции от концентрации отклоняется от линейной, а при достаточно большой концентрации вообще может уменьшаться, т.е. может начаться так называемое концентрационное тушение люминесценции. В этой связи верхний предел концентрации раствора в люминесцентном анализе обычно не превышает 10-3 – 10-4 моль/л.
Концентрационное тушение люминесценции по С.И.Вавилову в широком интервале концентраций во многих случаях описывается уравнением
В = В0ехр[-k(C-C0)],
Где В и В0 – выход люминесценции при концентрации С и С®0,
С0 – пороговая концентрация, при достижении которой развивается концентрационное тушение,
k – постоянная.
Однако это уравнение оказывается применимым не всегда. Существенное значение имеет температурное тушение люминесценции, т.е. уменьшение выхода свечения с повышением температуры. В той или иной степени это явление свойственно всем люминесцирующим веществам. Оно объясняется тем, что с повышением температуры увеличивается колебательная энергия молекул и возрастает вероятность безизлучательных переходов, а также вероятность диссоциации возбужденных частиц, происходящая без излучения квантов света. Относительное влияние на выход люминесценции оказывают многочисленные примеси. Тушение люминесценции лежит в основе нескольких методик определения примесей.
3. Схема прибора для люминесцентного анализа приведена на рисунке:
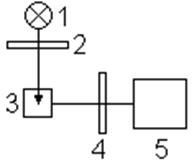
| Свет от источника света 1 проходит через светофильтр 2 и попадает на кювету 3 с исследуемым раствором. Выходящее под прямым углом к |
направлению возбуждающего света люминесцентное излучение проходит через светофильтр 4, который пропускает свет люминесценции и поглощает рассеянный свет от источника возбуждения, и попадает на приемник излучения. В практике люминесцентного анализа исследуемое вещество обычно освещают ультрафиолетовыми лучами. Наибольшее распространение среди различных источников излучения вызывающих люминесценцию получили газоразрядные лампы, чаще всего ртутно-кварцевые и ксеноновые. В современных приборах для количественного анализа в качестве приемника излучения используют фотоумножители.
Дата добавления: 2015-07-11; просмотров: 161 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Методы количественного анализа. | | | Качественный анализ. |