
Читайте также:
|
Открытие сложного строения атома – важнейший этап становления современной физики. В процессе создания количественной теории строения атома, позволившей объяснить атомные системы, были сформированы новые представления о свойствах микрочастиц, которые описываются квантовой механикой.
Представление об атомах как неделимых мельчайших частицах веществ, как уже отмечалось выше, возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743–1794), великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона (1766-1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д.И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. было экспериментально доказано, что электрон является одной из основных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе Менделеева, наталкивает на мысль о том, что в основе строения всех атомов лежит общее свойство: все они находятся в близком родстве друг с другом.
Однако до конца XIX в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Различные предположения о строении атома долгое время не подтверждались какими-либо экспериментальными данными. Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при определенных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома.
Первые косвенные подтверждения о сложной структуре атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Изучение свойств этих лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, близкой к скорости света. Особыми приемами удалось определить массу катодных частиц и величину их заряда, выяснить, что они не зависят ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов и превращены в электронейтральные частицы: электрический заряд составляет сущность их природы. Эти частицы, получившие название электронов, были открыты в 1897 г. английским физиком Дж. Томсоном.
В 1911 г. английским физиком Э. Резерфордом при исследовании движения альфа-частиц в газах и других веществах была обнаружена положительно заряженная часть атома. Дальнейшие более тщательные исследования показали, что при прохождении пучка параллельных лучей сквозь слои газа или тонкую металлическую пластинку выходят уже не параллельные лучи, а несколько расходящиеся: происходит рассеяние альфа-частиц, т. е. отклонение их от первоначального пути. Углы отклонения невелики, но всегда имеется небольшое число частиц (примерно одна из нескольких тысяч), которые отклоняются очень сильно. Некоторые частицы отбрасываются назад, как если бы на пути встретилась непроницаемая преграда. Это не электроны – их масса гораздо меньше массы альфа-частиц. Отклонение может происходить при столкновении с положительными частицами, масса которых того же порядка, что и масса альфа-частиц. Исходя из этих соображений, Резерфорд предложил следующую схему строения атома.
В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарная модель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
Планетарная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц вещества, однако возникли принципиальные трудности при обосновании устойчивости атомов.
Первая попытка построить качественно новую – квантовую – теорию атома была предпринята в 1913 г. Нильсом Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил ядерную модель Резерфорда. Он предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы – очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности.
Успехи теории атома водорода были получены ценой отказа от фундаментальных положений классической механики, которая на протяжении более 200 лет остается безусловно справедливой. Поэтому большое значение имело прямое экспериментальное доказательство справедливости постулатов Бора, особенно первого – о существовании стационарных состояний. Второй постулат можно рассматривать как следствие закона сохранения энергии и гипотезы о существовании фотонов.
В настоящее время с помощью квантовой механики можно ответить на многие вопросы, касающиеся строения и свойств атомов любых элементов.
Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания теории Бора атом водорода был хорошо изучен экспериментально. Он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в излучении атома водорода в видимой области (так называемый линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
|
Для серии Бальмера m = 2, n = 3, 4, 5,.... Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4,.... Постоянная R в этой формуле называется постоянной Ридберга. Ее численное значение R = 3,29·1015 Гц. До Бора механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода (и ряда других атомов), оставались непонятными.
Постулаты Бора определили направление развития новой науки – квантовой физики атома. Но они не содержали рецепта определения стационарных состояний (орбит) и соответствующих им значений энергии En.
Правило квантования, приводящее к правильным, согласующимся с опытом значениям энергий стационарных состояний атома водорода, было угадано Бором. Бор предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде
|
Здесь me – масса электрона, υ – его скорость, rn – радиус стационарной круговой орбиты. Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением
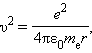
|
где e – элементарный заряд, ε0 – электрическая постоянная. Скорость электрона υ и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда следует, что радиусы стационарных круговых орбит определяются выражением
|
Самой близкой к ядру орбите соответствует значение n = 1. Радиус первой орбиты, который называется боровским радиусом, равен
|
Радиусы последующих орбит возрастают пропорционально n2.
Полная механическая энергия E системы из атомного ядра и электрона, обращающегося по стационарной круговой орбите радиусом rn, равна
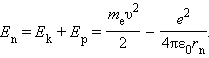
|
Следует отметить, что Ep < 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ2 и rn, получим:
|
Целое число n = 1, 2, 3,... называется в квантовой физике атома главным квантовым числом.
Согласно второму постулату Бора, при переходе электрона с одной стационарной орбиты с энергией En на другую стационарную орбиту с энергией Em < En атом испускает квант света, частота νnm которого равна ΔEnm / h:
|
Эта формула в точности совпадает с эмпирической формулой Ридберга для спектральных серий атома водорода, если положить постоянную R равной
|
Подстановка числовых значений me, e, ε0 и h в эту формулу дает результат
| R = 3,29·1015 Гц, |
который очень хорошо согласуется с эмпирическим значением R.
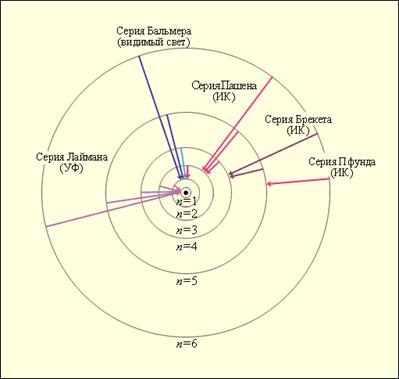
Рис. 5.6 и 5.7 иллюстрируют образование спектральных серий в излучении атома водорода при переходе электрона с высоких стационарных орбит на более низкие.
|
| Рис. 5.6. Стационарные орбиты атома водорода и образование спектральных серий. |

|
| Рис.5.7. Диаграмма энергетических уровней атома водорода. Показаны переходы, соответствующие различным спектральным сериям. Для первых пяти линий серии Бальмера в видимой части спектра указаны длины волн. |
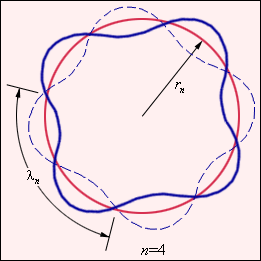
Прекрасное согласие боровской теории атома водорода с экспериментом служило веским аргументом в пользу ее справедливости. Однако попытки применить эту теорию к более сложным атомам не увенчались успехом. Бор не смог дать физическую интерпретацию правилу квантования. Это было сделано десятилетием позже де Бройлем на основе представлений о волновых свойствах частиц. Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Другими словами, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты (рис. 5.8). Это явление очень похоже на стационарную картину стоячих волн в струне с закрепленными концами.
|
| Рис.5.8. Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите для случая n = 4. |
В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн λ, то есть
| nλn = 2πrn. |
Подставляя в это соотношение длину волны де Бройля λ = h / p, где p = meυ – импульс электрона, получим:
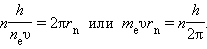
|
Таким образом, боровское правило квантования связано с волновыми свойствами электронов.
Представление о дискретных состояниях противоречит классической физике. Поэтому возник вопрос, не опровергает ли квантовая теория законы классической физики. Квантовая физика не отменила фундаментальных классических законов сохранения энергии, импульса, электрического разряда и т. д. Согласно сформулированному Н. Бором принципу соответствия, квантовая физика включает в себя законы классической физики, и при определенных условиях можно обнаружить плавный переход от квантовых представлений к классическим. Это можно видеть на примере энергетического спектра атома водорода (рис. 5.7). При больших квантовых числах n >> 1 дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, характерного для классической физики.
Половинчатая, полуклассическая теория Бора явилась важным этапом в развитии квантовых представлений, введение которых в физику требовало кардинальной перестройки механики и электродинамики. Такая перестройка была осуществлена в 20-е – 30-е годы XX века.
Представление Бора об определенных орбитах, по которым движутся электроны в атоме, оказалось весьма условным. На самом деле движение электрона в атоме очень мало похоже на движение планет или спутников. Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции |Ψ|2. Волновая функция Ψ является решением основного уравнения квантовой механики – уравнения Шредингера. Оказалось, что состояние электрона в атоме характеризуется целым набором квантовых чисел. Главное квантовое число n определяет квантование энергии атома. Для квантования момента импульса вводится так называемое орбитальное квантовое число l. Проекция момента импульса на любое выделенное в пространстве направление (например, направление вектора B магнитного поля) также принимает дискретный ряд значений. Для квантования проекции момента импульса вводится магнитное квантовое число m. Квантовые числа n, l, m связаны определенными правилами квантования. Например, орбитальное квантовое число l может принимать целочисленные значения от 0 до (n – 1). Магнитное квантовое число m может принимать любые целочисленные значения в интервале ±l (орбитального квантового числа). Таким образом, каждому значению главного квантового числа n, определяющему энергетическое состояние атома, соответствует целый ряд комбинаций квантовых чисел l и m. Каждой такой комбинации соответствует определенное распределение вероятности |Ψ|2 обнаружения электрона в различных точках пространства («электронное облако»).
Состояния, в которых орбитальное квантовое число l = 0, описываются сферически симметричными распределениями вероятности. Они называются s-состояниями (1s, 2s,..., ns,...). При значениях l > 0 сферическая симметрия электронного облака нарушается. Состояния с l = 1 называются p-состояниями, с l = 2 – D-состояниями и т. д.
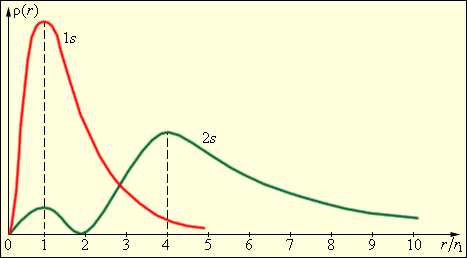
На рис. 5.9 изображены кривые распределения вероятности ρ(r) = 4πr2|Ψ|2 обнаружения электрона в атоме водорода на различных расстояниях от ядра в состояниях 1s и 2s.
|
| Рис.5.9. Распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s. r1 = 5,29·10–11 м – радиус первой боровской орбиты. |
Как видно из рис. 5.9, электрон в состоянии 1s (основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу r1 первой боровской орбиты. Вероятность обнаружения электрона в состоянии 2s максимальна на расстоянии r = 4r1 от ядра. В обоих случаях атом водорода можно представить в виде сферически симметричного электронного облака, в центре которого находится ядро
Дата добавления: 2015-10-21; просмотров: 156 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| И фотонов). | | | Соотношение неопределенностей и квантово-волновой дуализм |