
Читайте также:
|
Выделяют шесть классов ферментов:
1. Гидролазы – ферменты, расщепляющие субстрат при участии молекул воды.
2. Лиазы – ферменты, расщепляющие молекулы субстрата без участия воды, при этом часто образуются низкомолекулярные продукты – СО2, NH3, Н2О.
3. Изомеразы – ферменты, вызывающие в молекуле изомерные превращения.
4. Феразы (трансферазы) – ферменты, переносящие группы от одной молекулы на другую или из одного положения в другое в пределах одной молекулы.
5. Оксидоредуктазы - ферменты, катализирующие перенос протонов и электронов (т.е.окислительно-восстановительные реакции).
6. Лигазы(синтетазы) – ферменты, катализирующие синтез крупных молекул из более мелких.
Номенклатура ферментов.
Рабочее название фермента складывается из названия субстрата, типа катализируемой реакции и окончания –аза.
Систематическое название складывается из названия субстратов, названия типа катализируемого химического превращения и окончания –аза.
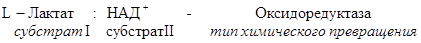
Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы – уточняет действие фермента, так как указывает на природу химической группы субстрата, атакуемой ферментом. Подкласс делится на подподклассы. Подподклассы конкретизируют действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
I. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Оксидоредуктазы называют также дегидрогеназами или редуктазами. Оксидоредуктазы переносят протоны и электроны. Оксидоредуктазы делят на подклассы:
1. Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
Коферментами оксидоредуктаз являются:
НАД – никотинамидадениндинуклеотид – содержит витамин В5 – никотинамид.
НАДФ – никотинамидадениндинуклеотид фосфат, содержит витамин В5.
ФАД – флавинадениндинуклеотид, содержит витамин В2 – рибофлавин.
ФМН – флавинмононуклеотид, содержит витамин В2 – рибофлавин.
Оксидоредуктазы катализируют реакции дегидрирования, т.е. отщепление водорода.
Оксидоредуктазы окисляют следующие функциональные группы:
-ОН, -С=О, -NH2
|
Н
Коферменты дегидрогеназ присоединяют протоны и электроны.
НАД-зависимые дегидрогенизы окисляют следующие функциональные группы: спиртовый гидроксил (ОН), альдегидную группу (СОН), аминогруппу (NH2).
НАД-зависимые дегидрогеназы катализируют следующие типы реакций:
1. Дегидрирование гидроксильных групп
СН3 СООН
| лактатдегидрогеназа |

 HC-O С=О
HC-O С=О
| |
COOH НАД+ НАДН +Н+ СН3
Лактат пируват
Молочная кислота
2. Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 – фосфата)
СН3 СООН
| + НАД+ + Н3РО4 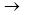 | + НАДН + Н+
| + НАДН + Н+
HC-OH НC-OН
| |
CH2OPO3H2 CH2OPO3H2
Глицеральдегид-3-фосфат 1,3-бифосфоглицериновая кислота
3. Дегидрирование аминогрупп
СООН СООН
| |
СН2 +НАД СН2
 | | + НАДН + Н+
| | + НАДН + Н+
СН2 глутаматдегидрогеназа СН2
| |
СНNH2 С=О
| |
COOH СООН
Глутаминовая кислота 
ФАД – зависимые дегидрогеназы окисляют (дегидрируют) следующие функциональные группы: отщепление водорода от групп –СН2- СН2- с образованием двойной связи.
Пример:
СООН СООН
| ФАД ФАДН2 |
 СН2 СН
СН2 СН
 | ||
| ||
СН2 сукцинатдегидрогеназа СН
| |
СООН СООН
Сукцинат фумарат
2. Анаэробные дегидрогеназы переносят протоны и электроны не на кислород, а на какой-то другой субстрат. Эти ферменты называют также оксигеназами.
II. Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому.
Подклассы трансфераз:
1. Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту. Катализируют реакцию трансаминирования.
2. Метилтрансферазы катализируют перенос метильных групп (СН3-).
3. Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. В подкласс фосфотрансфераз входят киназы, которые используют АТФ в качестве донора фосфатного остатка.
III. Лиазы – ферменты, катализирующие разрыв С-О, С-С, С-N и других связей, а также обратимые реакции отщепления различных групп, без участия воды.
1. Карбоксилазы – присоединение карбоксильной группы (СО2).
2. Дегидратазы – отнятие молекулы воды от субстрата.
3. Альдолазы – расщепляют связь С-С.
4. Гидратазы – ферменты воды по двойной связи.
IV. Изомеразы – ферменты, катализирующие превращение в пределах одной молекулы.
Катализируют реакции изомеризации. Подклассы: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы.
V. Гидралазы – ферменты, катализирующие разрыв связей в присутствии воды.
VI. Лигазы (синтетазы) – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи АТФ.
Влияние низкомолекулярных веществ на активность фенрментов.
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
1. Активаторы – ускоряющие протекание ферментативной реакции.
2. Ингибиторы – замедляют протекание ферментативных реакций.
Активаторы делят на 2 группы:
1. В качестве активатора могут выступать коферменты или простетическая группа (в основном витамины).
Для этой группы характерны те же закономерности, что описаны для взаимодействия фермента и субстрата F+S и A+Ko подчиняются одним закономерностям 

Km определяет сколько вводить Ko.
2. Активаторы, являющиеся связующим звеном между F и S (ориентирование фермента и субстрата) и обеспечивающим взаимодействие фермента и субстрата (F A S), взаимодействие апофермента и кофактора Апоф А Ко
Часто это ионы Ме – Со, Mn, Mg, Zn.
Значение ингибирования активности ферментов.
1. Ингибирование лежит в основе действия лекарственных веществ и токсических агентов.
2. Ингибирование – один из подходов к изучению ферментативного действия (например, структуры активного центра).
Ингибирование бывает 2-х видов:
1. Необратимое
2. Обратимое
Необратимое ингибирование имеет место тогда, когда присоединение ингибитора к ферменту носит необратимый характер.
 Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
F-S-H + J-CH2CONH2  F-S-CH2-CONH2 + HJ
F-S-CH2-CONH2 + HJ
Необратимым является действие токстческих фосфоорганических соединений, которые называют нервно-паралитическими ядами, они ингибируют ацетилхолинэстеразу, участвующую в передаче нервных импульсов.
Необратимое ингибирование
Многие ингибиторы необратимо связываются с Е или ES, и, поскольку это влияет на Vmax, такое ингибирование относят к неконкурентному.
Ингибиторы этого типа часто ковалентно связываются с ферментом или с комплексом фермент-субстрат, необратимо изменяя нативную конфигурацию. Это объясняет токсическое действие Hg2+, Pb2+ и соединений мышьяка.
На необратимом ингибировании основано действие пенициллина. Пенициллин ингибирует действие одного из ферментов, участвующих в сборке клеточной стенки бактерий. Клетки, ен имеющие клеточной стенки, легко лизируются.
Действие аспирина основано на ковалентной модификации фермента. Аспирин снижает скорость синтеза простагландинов, выступая в роли ингибитора циклооксигеназного компонента эндопероксид-синтетазы. Считается, что возникновение болей, воспалений, температуры связано с простагландинами.
При интоксикации связывание яда или его вытеснение из комплекса фермент-ингибитор возможно с помощью реактиваторов, или противоядий. К ним относятся все SH – содержащие комплексоны (цистеин, димеркаптопропанол), лимонная кислота.
Обратимое ингибирование бывает 2-х видов:
1. Конкурентное
2. Неконкурентное
Обратимое конкурентное ингибирование – активность фермента восстанавливается после удаления ингибитора путем увеличения концентрации субстрата.
Отличительный признак конкурентного ингибитора – конкурентный ингибитор по структуре близок субстрату. Конкурентный ингибитор конкурирует с субстратом за активный центр фермента.
Пример: сукцинатдегидрогеназа катализирует превращение сукцината в фумарат. Конкурентным ингибитором сукцинатдегидрогеназы является малоновая кислота, которая содержит на одну группу СН2 меньше, чем сукцинат.
СООН СООН COOH
| СДГ | |
 СН2
СН2  СН CH2
СН CH2
 | || |
| || |
СН2 СН COOH
| | малоновая кислота
СООН СООН
Сукцинат и малоновая кислота являются структурными аналогами и конкурируют за активный центр фермента. (Это является подтверждением тому, что активный центр не является жестким образованием, подходящим субстрату, как «ключ-замок».)
При конкурентном ингибировании степень ингибирования фермента не зависит от абсолютной концентрации ингибитора, а от соотношения ингибитора и субстрата, если это соотношение J:S=1:50, то активность фермента ингибируется на 50%.
Действие конкурентного ингибитора снимается повышением концентрации субстрата, так как сродство фермента и субстрата выше, чем сродство фермента и ингибитора.
Кm F и S и Km F и J различны и это узнают путем построения графиков Михаэлиса-Ментен и Лайнуэвера-Бэрка
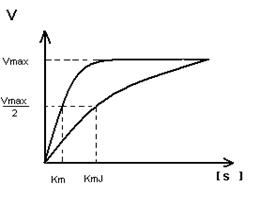

Vmax – одинакова
Km с ингибитором увеличивается.
Действие многих химиотерапевтических средств основано на конкурентном ингибировании. Например, сулфаниламидные препараты, используемые для лечения болезней, вызываемых микробными инфекциями. Сульфаниламидные препараты по структуре сходны с п-аминобензойной кислотой. ПАБК является предшественником в микробиологическом синтезе фолиевой кислоты, из которой кофермент, необходимый для синтеза нуклииновых кислот микроорганизмов. При введении сульфаниламидных препаратов наблюдается угнетение фермента и гибель микроорганизмов.
На конкурентном ингибировании основано применение и фторурацила, который используется при лечения рака.
Неконкурентное, обратимое ингибирование.
Действие неконкурентного ингибитора не может быть устранено увеличением концентрации субстрата.
Неконкурентный ингибитор не связывается с активным центром, он может связываться со свободным ферментом  , либо с комплексом FS
, либо с комплексом FS 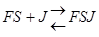 , либо с тем и другим, но обе формы JF и JFS – не активны.
, либо с тем и другим, но обе формы JF и JFS – не активны.
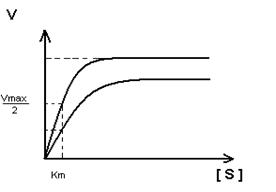

Km- не изменяется, т.к. нет связывания с активным центром.
Vmax – уменьшается.
Наиболее общий тип неконкурентного ингибирования имеет место при действии реагентов, обратимо связывающих SH-группы цис, входящего в каталитический центр или близко от него. Это ионы Cu2+, Hg2+, Ag+ и их производные с образованием меркаптидов:

Ферменты, для активации которых необходимы ионы Ме ингибируются по такому способу агентами связывающими эти ионы:
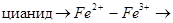 ферро или ферроцианид.
ферро или ферроцианид.
Регуляция активности ферментов.
Использование ферментов в фармации, медицине.
Виды регуляции активности ферментов:
1. Аллостерическая модификация.
2. Активация зимогенов.
3. Регуляция путем химической модификации.
Аллостерическая модификация.
 Этот вид активации характерен для ключевых обменных процессов:
Этот вид активации характерен для ключевых обменных процессов:

Ключевой фермент начинает (открывает) процесс.
Ферменты, от активности которых зависит скорость процесса, называются регуляторными или аллостерическими.
Дата добавления: 2015-10-13; просмотров: 124 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Факторы, влияющие на активность ферментов. | | | Особенности аллостерических ферментов. |