
Читайте также:
|
Структура и свойства ферментов.
Ферменты (энзимы) – специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов.
Доказательства белковой природы ферментов.
1. Инативация ферментов при нагревании. Инактивация ферментов совпадает с денатурацией белка. Ферменты разрушаются также под действием минеральных кислот, щелочей, солей, алкалоидов, при облучении рентгеновскими и ультрафиолетовыми лучами.
2. Электрохимические свойства ферментов.
a. Изоэлектрическая точка ферментов.
b. Поведение ферментов при изменении концентрации водородных генов.
c. Высокая специфичность ферментов.
d. Ферменты не способны проникать через полупроницаемые мембраны.
e. Сохранение активности ферментами после действия водоотнимающими средствами (ацетон, спирт, нейтральные соли щелочных металлов).
Для ферментов и неорганических катализаторов характерны общие свойства:
1. Неорганические катализаторы и биологические катализаторы – ферменты требуются в небольшом количестве для проведения реакции.
2. Катализаторы биологические и неорганические выделяются после реакции в неизменном виде.
3. Катализаторы не сдвигают химического равновесия.
4. Катализаторы биологические и небиологические ведут реакцию в обход энергетического барьера, т.е. снижают энергию активации.
Отличия:
1. Ферменты обладают более высокой биологической активностью.
Пример: уреаза разлагает мочевину за 10-4 сек, а под действием воды этот процесс пройдет за 3200 лет.
Гидролиз белков
без фермента 100 – 1100С, 20% HCl – 8-10 часов
с ферментом 370С, pH 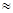 7,0 – 1-1,5 часа
7,0 – 1-1,5 часа
2. Высокая специфичность действия ферментов.
Белок  аминокислоты.
аминокислоты.
Протеолитические ферменты разрывают определенные пептидные связи. Ферменты катализируют превращение определенного субстрата или группы субстратов.
3. Активность ферментов зависит от t, pH. Ферменты действуют в более мягких условиях t=370-380, pH – организма, микроэлементы.
4. ферменты действуют последовательно и кооперативно (т.е. сообща).
S 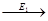 A
A 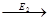 B
B 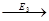 C
C 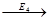 P
P
5. Локализация ферментов по отдельным компартментам.
6. Активность ферментов регулируется.
7. Скорость ферментативной реакции зависит от концентрации фермента.
Ферменты классифицируют по химической структуре:
| Ферменты (энзимы) Простые Сложные | ||
| (состоят из аминокислот, относятся пищеварительные ферменты: пепсин, трипсин, амилаза, ДНК-аза) | Белковая часть (апофермент состоит из аминокислот) | Небелковая (кофактор; витамины, нуклеотиды, ионы Ме: Fe, Mg, Co, Zn) |
Кофактор делят на 2 группы в зависимости от прочности связи:
1. кофермент – легкоотделяемая небелковая часть
2. простетическая группа – трудноотделяемая часть фермента.
Дата добавления: 2015-10-13; просмотров: 217 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Биологическое окисление. | | | Функции белковой и небелковой части фермента. |