
|
Читайте также: |
Демек, концентрация бірге тең болып, температура бірдей болған жағдайда, тіке реакция кері реакциядан неше есе жылдам жүретінін көретеді. К-концентрацияның өзгергенінен өзгермейді, бірақ температураға тәуелді болады.
Химиялық тепе-теңдік константасын іс жүзінде қолданатын маңызды ережелер:
1. Қайтымды процесте реакцияласушы заттың біреуін толығырақ пайдалану үшін, оны екіншісінен артық алу керек.
2. Түзілуші заттар қайта реакцияласа алмау үшін, оның біреуін реакциядан шығарса, тепе-теңдік ыңғай сол шығарылған заттың орнын толтыратын жаққа қарай ауады, бұл жағдайда қайтымды реакция аяғына дейін барады.
Лө-Шателье принципі - термодинамикалық тепе-теңдік тұрған жүйеге тепе-теңдік күйін анықтаушы кез-келген бір параметрін өзгертіп сырттан әсер етсе, жүйеде сыртқы күштің әсерін төмендететін бағыттағы процесс күшейеді дейтін ереже.
Химиялық тепе-теңдік күйіне келіп тұрған жүйенің жағдайын (концентрация, температура, қысым) біреуін өзгерту, тепе-теңдікті сол өзгеруге қарсы туғызатын реакция бағытына қарай ығыстырады.
Температура көтерілгенде тепе-теңдік эндотермиялық реакция бағытына қарай, ал температура төмендегенде экзотермиялық реакция бағытына қарай ығысады. Мұны Вант-Гофф заңы деп атайды. Вант-Гофф заңы Лө-Шателье принципінің бір жеке түрі.
Химиялық тепе-теңдік тұрған заттардың ішінде газ күйіндегі заттар болса, онда тепе-теңдікке қысымның да әсері болады.
Лө-Шателье принципіне сәйкес тепе-теңдікте тұрған жүйенің сыртқы қысымын күшейткенде тепе-теңдік жүйедегі молекулаларының жалпы саны азаятын реакцияның бағытына қарай ығысады. Керісінше, сыртқы қысымды азайтқанда тепе-теңдік жүйедегі газ молекулаларының жалпы саны көбейетін реакцияның бағытына қарай, яғни ішкі қысымның өсу жағына қарай ығысады. Мысалы,
N2+3H2Û2NH3+Q
4. ХИМИЯЛЫҚ РЕАКЦИЯНЫҢ ЖЫЛДАМДЫҒЫ
Химиялық реакцияның жылдамдығы кесімді уақыт ішінде реакцияласушы заттардың концентрациясының өзгеруімен анықталады.
Химиялық реакцияның жылдамдығына, реакцияласушы заттардың табиғи қасиетінен басқа, реакциялық жағдай да әсер етеді (олар: температура, реакцияласушы заттардың концентрациясы, катализатор қатысуы).
Осы жағдайдың әсеріне байланысты химиялық реакциялардың жылдамдығын зерттеуді – химиялық кинетика дейді, яғни химиялық процестердің жылдамдығын зерттейтін химия ғылымдарының арнаулы бір саласы.
Температураның әсері. Температураны өсіргенде молекулалардың қозғалыс жылдамдығы артады, демек, олардың өз-ара кездесіп соқтығысуы жиілейді. Температураны әр-бір 100 өсіргенде реакцияның жылдамдығы 2-4 есе артады. Кездесіп түйісетін бөлшектердің энергиясы, олардың электрон қауыздарының бір-бірін тебу үшін (энергетикалық тосқауыл) басым болуы шарт.
Температураны көтергенде жалпы молекулалардың кинетикалық энергиясы өседі, оның ішінде активті молекулалардың да саны көбейеді, реакциялық соқтығысу саны көбейіп, реакцияның жылдамдығы артады.
Реакцияласушы заттардың бір моліндегі молекулалардың барлығын активті молекулаға айналдыру үшін жұмсалатын энергияны активтендіру энергиясы деп атайды.
Кинетикалық теңдеулер: V=KDC (гомогендік процестер)
V= KFDC (гетерогендік процестер)
К, DC және Ғ – технологиялық процестердің жылдамдығына әсер ететін негізгі параметрлер. К – технологиялық процестің жылдамдылық константасы, оны негізінде үш жолмен арттыруға болады:
1. Әрекеттесуші жүйенің темературасын көтеру.
2. Кинетикалық аймақта жүретін процестерге катализатор қолдану
3. Фазалар аралығындағы диффузияны арттыру.
1. Температураның жоғарылауы жылдамдылық константасын тым көп мөлшерде көбейтсе, диффузия коэффициентін аз мөлшерде арттырады.
Кинетикалық аймақта жүретін көпшілік процестердің жылдамдылық константасының температураға тәуелділігі Арренус теңдеуімен анықталады.
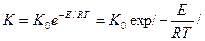
Бұл теңдеуді логарифм деп өңдегенде:
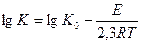 |
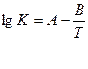 |
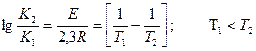
Мұнда: К1 және К2 – тиісті абсолюттік температурадағы реакция жылдамдығының константалары, l – натуралдың логорифм негізгі, Е- активтеу энергия шамасы. R – молярлық тұрақтысы, Дж/(мольград). Аррениус теңдеуін пайдаланып Е және К1 белгілі болса, Т2 температураға сәйкес К2 есептеуге болады, осы сияқты Е – анықталынады. Аррениус теңдеуі бойынша тіке реакция жылдамдығы температураға көтерілген сайын арта береді, бірақ іс жүзінде процесті қарқындату температураны шексіз тым жоғарылата беруге болмайды, себебі экзотермиялық қайтымды процестерде температура жоғарылаған сайын өнімнің тепе-теңдік шығымы төмендейді.
Осы сияқты тым жоғары температурада реагенттердің және аппарат құрылған материалдардың төзімділігі төмендейді. Осы жағдайды естен шығармай процеске лайықты оңтайлы ұтымды температура белгіленеді.
2. Оң әсерін тигізетін катализаторлар бір сатыда үлкен активтеу энергия қажет ететін реакция жылдамдығын көп сатылы аз мөлшерде активтеу энергия қажет ететін реакцияға ауыстыру арқылы реакция жылдамдығын өсіреді.
3. Араластыру – молекулалық диффузияны конвективті диффузияға ауыстыру нәтижесінде процестің жылдамдылық константасын көбейтеді.
Гомогенді процестерде араластыру реакция саласындағы концентрацияны теңестіреді, реакцияласушы молекулалардың соқтығысу саны артады.
Гетерогенді жүйелерді араластыру баяу молекулалар диффузиясын жылдам конвективтік диффузияға аударады.
Концентрацияның әсері. Химиялық реакцияны тездету үшін реакцияласушы заттардың молекулалары жиі соқтығысу қажет, түйісуді жиілендіру үшін реакцияласушы молекулалардың концентрациясын өсіру керек.
Химиялық реакцияның жылдамдығы реакцияласушы заттар концентрацияларының көбейтіндісіне тура пропорционал - әрекеттесуші массалар заңы:
V=K×[A]n[B]m
К – жылдамдық константасы (реакцияласушы заттардың концентрациясы бірге тең (1 моль/л)) болған жағдайдағы реакция жылдамдығы.
К - әрбір реакцияның өзіне лайықты тұрақты шама, ол тек қана реакцияласушы заттардың табиғатына қарай және температураға байланысты өзгереді.
5. КАТАЛИЗ
Катализаторлар – реакцияның жылдамдығын өзгертіп, бірақ реакция нәтижесінде өздері химиялық өзгермей қалатын заттар.
Катализатор қатысуымен болатын процестер жаратылыста да, өнеркәсіпте де өте көп. Қазіргі заманның өнеркәсібінде, әсіресе химиялық өнеркәсіпте, катализаторлар ерекше орын алуда.
Әр бір реакцияға өзіне тән, лайық катализатор болады. Кей жағдайда түрлі катализатор қолдану арқылы, бір заттан әр түрлі өнімдер алуға болады.
Al2O3 C2H4+H2O (этилен)


 С2H5OH H3PO4 C2H5OCH+H2O (диэтил эфирі)
С2H5OH H3PO4 C2H5OCH+H2O (диэтил эфирі)


 MgO;K2O CH3CHO+H2 (сірке альдегиді)
MgO;K2O CH3CHO+H2 (сірке альдегиді)
Реакцияға катализатор қатысқанда ондағы актив молекулалар саны өседі, содан барып реакция жылдамдайды. Екінші жағынан катализатор қатысқанда активтендіру энергиясы кемиді.
Катализатор қатты, сұйық және газ күйінде де болады.
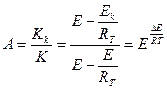 |
Мұндағы: Кк – катализатор қатысында реакцияның жылдамдық константасы; К –катализаторсыз реакцияның жылдамдылық константасы; Е=Е-Ек, Е – катализаторсыз реакцияның активтену энергиясы; Ек – катализатор қатысқанда реакцияның активтену энергиясы.
Катализатор активтілігіне көптеген факторлар әсер етеді. Олар катализатор құрамы, катализатордың беткі қабат ауданы, кедір-бұдырлығы технологиялық режим параметрлері.
Катализатордың өзіне тән тұтану температурасы болады, яғни ол өндірісті қанағаттандыратын катализатор активтілігі орнайтын ең төменгі температура шамасы.
Катализаторлың жұмыс атқаратын температураның жоғарғы және төменгі шегі болады. Жоғары шегі – катализатордың, шикізаттардың және өнімнің температураға төзімділігіне, төменгі шегі – тұтану температураға тәуелді болады.
Катализатордың ерекше бір қасиеті – улану, контакт улары қатарына жататындар: күкірт қосындылары, көгерткіш қышқыл (HCN), көмір оксиді (СО), сынап тұздары, күшән, қорғасын қосылыстары және т.б. Катализатордың улануы қайтымды және қайтымсыз болып екіге бөлінеді.
Катализаторлар активтілігін кейде жоғары температурада, пісуі (спекание) немесе аз да болса катализатор бетінің балқуы да төмендетеді, тағыда осы сияқты катализатор бетіне реакцияласушы қатты зат бөлшектерін немесе тозаңның жыйналуы да активтікті төмендетеді. Катализатор активтігін қайта бастапқы қалпына келтіру (регенерация) әр түрлі механикалық немесе физика-химиялық әдістерімен орындалады.
өндірісте көбінесе қолданылытын катализатор күрделі қоспадан құралады, осы себептен оларды контакт массасы деп атайды. Контакт масса құрамында: катализатор (активтік фаза), тасымалдағыш және активатор (промотор) болады.
Тасымалдағыштар – температураға төзімді, инертті, кеуекті заттар. Тасымалдағыштар катализатор қасиетін жақсартады және арзандатады. Тасымалдағыштар ретінде қолданылатын кеуекті заттар – пемза, әк, силикагель және т.б.
Активатор немесе промоторлар - өздері активтілік көрсетпейтін, біраз негізгі катализатордың активтілігін арттыратын заттар. Мысалы, сілтілік металдар оксидтері темір катализаторларының, ванадий катализаторларының активтілігін арттырады (жоғарылатады).
Катализатор сапасының негізгі көрсеткіштері: активтілігі, таңдамалы әсері, уларға және температураға төзімділігі, механикалық беріктілігі, арзандығы, жылу өткізгіштігі мүмкіншілік болғанынша жоғары болу қажет.
Катализаторларды түйір, таблетка, гранул түрінде де дайындайды, кейде жіңішке тоқыма түрде де қолданады.
Катализаторды дайындаудың жиі қолданылатын әдістері – 1) гидроксидтерді немесе карбонаттарды (оларды тұз ертінділерінен) тасмалдағыштарға қондырып белгілі пішін беріп және қыздыру әдісімен дайындайды. 2) Контакт массаның құрамындағы барлық компонент қоспаларын жоғары қысымда престеу. 3) Бірнеше заттар қоспасын балқытып құйма түрінде дайындау. 4) Катализатор және активатор ерітінділерін кеуекті тасмалдағыштарға сіңіру.
Дата добавления: 2015-09-03; просмотров: 488 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ХИМИЯ-ТЕХНОЛОГИЯЛЫҚ ПРОЦЕСТЕРІНДЕ ҚОЛДАНЫЛАТЫН ФИЗИКА-ХИМИЯЛЫҚ ЗАҢДЫЛЫҚТАР | | | ОТЫНДЫ ХИМИЯЛЫҚ өҢДЕУ |