
|
Читайте также: |
Опыт 1.
| № стакана | Объем раствора,мл Na2S2O3 | H20 | Относительная конценрация Na2S2O3

| Время,с. | Скорость реакции
V= 
|
| 1. 2. 3. 4. | 6 | 0 4 | 2 3 | 3 2 | 4 | 2/3 1/2 1/3 | 0.067 0.053 0.045 0.033 |
В 4-е пробирки наоиваем 6мл 0.5М раствора серной кислоты и в 4-е нумерованных стаканчика наливаем указанное в таблице количество миллилитров 0.5M раствора тиосульфита натрия и воды.Из пробирок наливаем в соответствующий стаканчик серную кислоту.Мешаем получившуюся смесь.Засекаем время до появления мути.
Опыт 2(3б)
В сухой ступке осторожно смешиваем несколько кристаллов нитрата свинца и иодида калия.Энергично мешаем порошкообразную смесь пестиком.Далее добавляем воды.
Опыт 3(4а)
Пробирка 1
В пробирку наливаем на ¼ объема перекись водорода и прибавить небольшое количество оксида марганца(IY)
Пробирка 2
В пробирку наливаем на ¼ объема перекись водорода и прибавить небольшое количество оксида кремния(IY)
Пробирка 3
В пробирку наливаем на ¼ объема перекись водорода и прибавить небольшое количество оксида железа(III)
Опыт 4(4б)
Пробирка 1
В пробирку наливаем на 1/3 объема 0.5М раствор серной кислоты.Бросаем в пробирку кусочек цинка и добавляем 5 капель 0.1М раствора манганата(YII) калия.
Пробирка 2
В пробирку наливаем на 1/3 объема 0.5М раствор серной кислоты.Бросаем в пробирку кусочек цинка и добавляем 5 капель 0.1М раствора манганата(YII) калия.Добавляем несколько кристалликов нитрата(Y) калия в качестве катализатора
Обсуждения резульатов
Опыт 1.
Заполняем тбаличку.Записав необходимые данные,считаем скорость реакции.По данным таблицы видно,что с уменьшением концентрации Na2S2O3 уменьшается скорость реакции.Для наглядности покажем получившиеся результаты на графике.
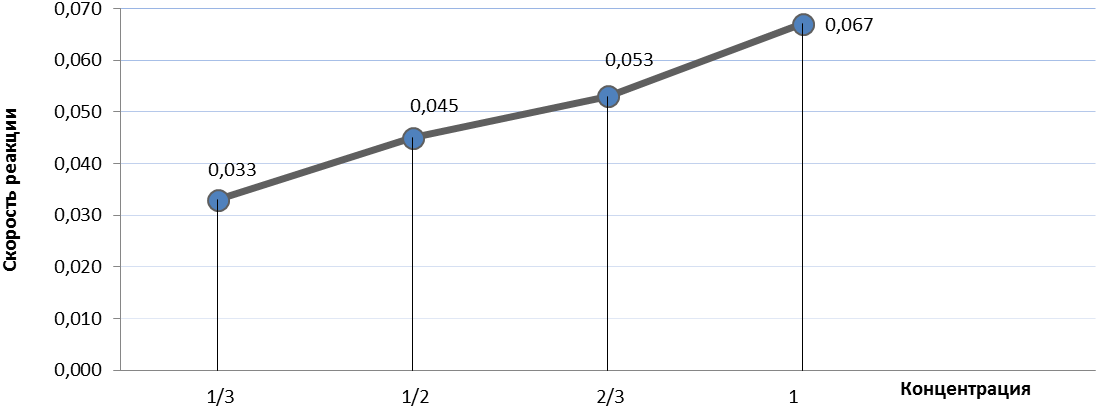
На графике мы ещё раз убеждаемся,что с уменьшением концентрации,уменьшается скорость реакции.
Опыт 2(3б).
При мешании порашка пестиком,наблюдаем заметное пожелтение порошкообразной смеси.При добавлении воды смесь моментально окрашивается в ярко-желтый цвет.
Pb2+(NO2)2-+2K+I-=2K(N+5O3-2)+PbI2
При добавлении воды скорость химической реакции увеличивается и смесь моментально окрашивается в ярко-желтый цвет.
Опыт 3(4а)
Пробирка 1
При добавлении к перекеси водорода окисида марганца,мы наблюдаем изменение окраски раствора в черный цвет и выделение газа.
2H2O2(+MnO2-катализатор)=O2+2H2O
Пробирка 2
При добавлении к перекеси водорода окисида кремния,наблюдаем выпадение белого осадка в виде кристалликов и выделение газа.
SiO2+2H2O2=O2+2H2O+SiO2
Пробирка 3
При добавлении к перекеси водорода оксида железа наплюдаем выпадение коричневого осадка и выделение газа.
FeO2+2H2O2=O2+2H2O+Fe
Вывод:Проведя реакции одновременно,можно заметить,что при различных катализаторах различна скорость реакции.
Опыт 4(4б)
Раствор обесцвечивается и в пробирке 1,и в пробирке 2.Но во второй эта реакция происходит быстрее,то есть катализатор(в данном случает нитрат (Y) калия)оказывает прямое воздействие на скорость реакции.
Каталитическое действие иона NO3- объясняется тем,что нитрат (Y) калия восстанавливается атомарным водородом,выделяющимся про взаимодействии цинка с серной кислотой,значительно быстрее,чем манганат(YII) калия.Образующийся нитрат (III) калия
5HNO3+10H=5KNO2+5H2O
Легко восстанавливает манганат(YII) калия
5KNO2+2KMnO4+3H2SO4=5KNO3+2MnSO4+K2SO4+3H2O
Таким образом,нитрат(Y)калия,участвуя в промежуточных стадиях реакции,способствует более быстрому её протеканию,но в конце реакции остается в первоначально взятом количестве.
Вывод
Изучив теоретический материал,мы увидели,что на скорость химической реакции могут оказывать воздействия различные факторы.На практике мы убедились в том,что на скорость реакции воздействует катализаторы,концентрация реагентов и среда.Мы наблюдали опыты с выделением газа,обесцвечиванием раствора,выпадением осадка,изменением окраски раствора.
Дата добавления: 2015-10-23; просмотров: 95 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Теоретический материал. | | | Методы расчета константы равновесия |