
Читайте также:
|
Нижегородский Государственный Технический Университет им. Р.Е. Алексеева
Кафедра «Органическая химия»
Лабораторная работа по теме
«Окислительно-восстановительные реакции»
Выполнил: Студент гр. 11-МТ
Семаев Е.Д.
Проверил: Кутьин Александр
Павлович
Нижний Новгород
Год
Цель работы
Изучение окислительно-восстановительных реакций.
Теоретический материал
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны
Атомы, отдающие электроны и повышающие свою степень окисления, называются восстановителями. Процесс принятия электронов называется восстановлением, а процесс отдачи электронов – окислением.
Выделяют три основных класса окислительно-восстановительных реакций.
1. Реакции межмолекулярного окисления–восстановления – реакции, в которых атомы окислителя и восстановителя входят в состав молекул разных веществ.
2. Реакции внутримолекулярного окисления восстановления – реакции, в которых атомы окислителя и восстановителя входят в состав одной молекулы.
3. Реакции самоокисления–самовосстановления (реакции оиспропорциони-рования) – те, в которых окислителем и восстановителем является один и тот же атом.
Для уравнивания коэффициентов в окислительно-восстановительных реакциях, а также для предсказания их возможных продуктов используется метод ионно-электронного баланса. При составлении уравнений с помощью данного метода считается, что реакция протекает в виде двух «полуреакций» – окисления и восстановления, причём атомы окислителя или восстановителя рассматриваются в составе тех ионов, в виде которых они присутствуют в растворе после диссоциации вещества. При уравнивании полуреакций по веществу в кислой среде можно использовать только H2O и H+, в щелочной – только H2O и ОH–, в нейтральной среде можно использовать молекулы воды и ионы, которые получаются в полуреакции восстановления.
Практическая часть
Опыт 1
Пробирка №1
В 0.1М раствор манганата (VII) калия наливаем 2 мл разбавленной серной кислоты. Затем добавляем несколько кристалликов сульфата (IV) натрия.
Раствор обесцветился.
Пробирка №2
В 0.1М раствор дихромата калия наливаем 2 мл разбавленной серной кислоты.
Затем добавляем несколько кристалликов сульфата (IV) натрия.
Цвет раствора изменился на зелено-болотный.
Опыт 2
Пробирка №1
В 0.1М раствор манганата (VII) калия наливаем 2 мл разбавленной серной кислоты. Затем добавляем несколько кристалликов нитрата (III) натрия. Раствор обесцветился. Выделился газ.
Пробирка №2
В 0.1М раствор дихромата калия наливаем 2 мл разбавленной серной кислоты.
Затем добавляем несколько кристалликов нитрата (III) натрия. Цвет раствора изменился на зеленовато-коричневый. Выделился газ.
Опыт 3
Пробирка №1
В 0.1М раствор манганата (VII) калия добавить 2 мл концентрированного раствора щелочи и несколько кристалликов сульфата (IV) натрия. Цвет раствора изменился на светло-зеленый.
Пробирка №2
В 0.1М раствор манганата (VII) калия добавить 2 мл воды и несколько кристалликов сульфата (IV) натрия. Цвет раствора изменился на желтый.Образовался светло-коричневый осадок.
Опыт 4
Сухую пробирку с небольшим количеством кристаллического дихромата аммония нагреть до начала реакции, а затем нагревание прекратить. При этом наблюдаем обилие ярких искр и образуется серовато зеленый оксид хрома (Cr2O3).Цвет порашка увеличился на темно-зеленый. Объем оксида хрома во много раз превышает объем исходного дихромата аммония.
Реакция разложения дихромата аммония протекает с выделением большого количества тепла, поэтому после нагревания соли она протекает самопроизвольно - до тех пор, пока весь бихромат не разложится.
Обсуждение результатов
Опыт 1
Пробирка №1
Смесь обесцветилась, так как роль красителя (розового цвета) принимал на себя ион MnO4-. В ходе реакции Mn7+ в ионе восстанавливается до Mn2+ в MnSO4, поэтомуокраска раствора обесцвечивается.
KMnO4+Na2SO3+H2SO4 → MnSO4+Na2SO4+K2SO4+H2O
K+MnO4- + Na3+2SO32- + H2SO4 → Mn2+SO42- + Na+2SO42- + K2SO4 + H2O
MnO4-+ 8H+ + 5e- → Mn2+ + 4H2O │ 2 восстановление
SO32- + H2O → SO42- + 2H+ + 2e- │ 5 окисление
2MnO4- + 16H+ + 5SO32- + 5H2O → 2Mn2+ + 8H2O + 5SO42- + 10H+
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Пробирка №2
Цвет раствора изменился на зелено-болотный. Так как роль красителя (оранжевого цвета) принимал на себя ион Cr2O72-. В ходе реакции Cr6+ в ионе восстанавливаетсядо Cr3+ в Cr2(SO4)3, поэтомуокраска изменилась на зелено-болотный.
K2Cr2O7 + Na2SO3 + H2SO4→K2SO4 + Cr2(SO4)3 + Na2SO4 + H2O
K+2Cr2O72- + Na+2SO32- + H2SO4→K+2SO42- + Cr2(SO4)2-3 + Na+2SO42- + H2O
Cr2O72- + 14H+ +6e-→2Cr3+ + 7 H2O │ 1 восстановление
SO32- +H2O →SO42-+ 2H+ + 2e- │ 3 окисление
Cr2O72- + 14H+ + 3SO32- +3H2O→ 2Cr3+ + 7H2O + 3SO42- + 6H+
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3Na2SO4 + 4H2O
Опыт 2
Пробирка №1
Раствор обесцветился, так как роль красителя (розового цвета) принимал на себя ион MnO4 (2-). При его переходе в MnSO4 окраска раствора обесцвечивается.
Выделился газ NO2.
KMnO4 + NaNO2 + H2SO4 → MnSO4 + NO2 + K2SO4 + Na2SO4 + H2O
K(+)Mn(7+)O4 + NaN(3+)O2 + H2SO4→Mn(2+)SO4 +NO2 +K2SO4 +Na2SO4 +H2O
MnO4(2-) + 8 H(+) +5e → Mn(2+) + 4H2O │ 1 восстановление
NO2(-)→NO2 + 1e │ 5 окисление
2 MnO(4-)+ 16 Н(+) + 10 NO(2-) → 2 Mn(2+) + 8 H2O + 10 NO2
2KMnO4 + 8H2SO4 + 10NaNO2 = 10 NO2 + 8 H2О + 2 MnSO4 + 5 Na2SO4 + K2SO4
Пробирка №2
Цвет раствора изменился на зеленовато-коричневый. Так как роль красителя (оранжевого цвета) принимал на себя ион Cr2O7 и при его переходе в Cr2(SO4)3 окраска изменилась на зелено- коричневый .(Аналогично Опыту 1 Пробирке 2). Выделился газ NO2.
K2Cr2O7 + NaNO2 + H2SO4 → K2SO4+Cr2(SO4)3+Na2SO4 + NO2+H2O
K2Cr2O7 (2-) + NaNO2(-) + H2SO4 → K2SO4+Cr2(3+) (SO4)3+Na2SO4 + NO2+H2O
Cr2O7(2-) + 14H(+)+6e → 2Cr(3+) + 7 H2O │1 восстановление
NO2(-) → NO2 + 1e │6 окисление
Cr2O7(2-)+ 14H(+)+6NO2(-) → 2Cr(3+) + 7 H2O+6 NO2
К2Cr2O7 +6NaNO2+7H2SO4 = K2SO4+Cr2(SO4)3+3Na2SO4+6NO2+7H2O
Опыт 3
Пробирка №1
Цвет изменился на зеленый, так как роль красителя (розового цвета) принимал на себя ион MnO4 -,при его переходе в MnO4 2- цвет меняется на зеленый. Среда щелочная.
KMnO4 + KOH + Na2SO3 → Na2SO4 + K2MnO4 + H2O
KMnO4-+ KOH + Na2SO32-→ Na2SO42- + K2MnO42-+ H2O
MnO4-+ 1e- → MnO42- │ 2 восстановление
SO32-+ 2OH-→ SO42- + H2O + 2e- │ 1 окисление
MnO4- + SO32- + 2OH- → MnO42-+ SO42- + H2O
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
Пробирка №2
Цвет изменился на желтый, так как роль красителя (розового цвета) принимал на себя ион MnO4 (-),при его переходе в MnO2(0) цвет меняется на желтый.Выпал бурый осадок MnO2. Среда нейтральная.
KMnO4 + H2O + Na2SO3 → Na2SO4 + MnO2 + KOH
KMnO4- + H2O + Na2SO32- → Na2SO42- + MnO2 + KOH
MnO4 -+ 2H2O + 3e- → MnO2+ 4OH- │2 восстановление
SO32-+ 2OH-→ SO42-+ H2O + 2e- │3 окисление
2 MnO4 - + 4H2O + 3SO32- + 6OH- → 2 MnO2+ 8OH- + 3SO42- + 3H2O
2KMnO4 + H2O + 3Na2SO3 = 3Na2SO4 + 2MnO2 + 2KOH
Опыт 4
Появляется обилие ярких искр и образуется серовато зеленый Cr2O3- "вулканический пепел". Объем оксида хрома во много раз превышает объем исходного дихромата аммония.
Реакция разложения дихромата аммония протекает с выделением большого количества тепла, поэтому после нагревания соли она протекает самопроизвольно - до тех пор, пока весь бихромат не разложится.
В ходе реакции Cr 6+ восстанавливается до Cr 3+, поэтому цвет (оранжевый) меняется на зеленый. N3- окисляется и переходит в N2 -газ, в результате котороговылетали из пробирки частицы Cr2O3.
(NH4)2Cr2O7 → N2+H2O+Cr2O3
(N3-H4)2Cr26+O7 → N20+H2O+Cr23+O3
2Cr 6+ + 3e- → 2Cr 3+ |2 восстановление
2N3-→ N20 + 6e- |1 окисление
(NH4)2Cr2O7 = N2+4H2O+Cr2O3
Выводы:
Изучив теорию,нам удалось выяснить, что в ходе реакции элементы способны менять сою степень окисления. На практике мы убедились, что во всех трех реакциях происходило изменение окраски растворов в зависимости от их среды, природы и восстановителей.
Вредные вещества, применяемые в работе
| № | Вещество | Действия на организм | Профилактика | |
| K2Cr2O7 | Поступая в организм вызывает тяжелые отравления: токсическое воздействие, заболевание органов дыхания и кожи, образование язв. | 1)При раздражении слизистой дыхательных путей - свежий воздух, ингаляции содового раствора. 2) При попадании на кожу и слизистые - немедленное обильное промывание проточной водой. | ||
| KOH | При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги. | При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струей воды, а при попадании на кожу слабым раствором уксусной кислоты. | ||
| H2SO4 | Поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. | 1)При попадании в глаза после обильного промывания впустить по 1 капле 2% раствора новокаина или 0,5% раствор дикаина с адреналином. 2) При раздражении слизистой дыхательных путей - свежий воздух, ингаляции содового раствора. 3) При попадании на кожу - немедленное обильное промывание проточной водой. | ||
| KMnO4 | Поражение кожи: аллергическая реакция, раздражение. Раздражение слизистых оболочек. | 1)При попадании на кожу - немедленное обильное промывание проточной водой. 2)При попадании внутрь – промывание желудка H2O2. | ||
| (NH4)2Cr2O7 | Является веществом,небольшая доза которого может привести к литальному исходу. | Избегать попадания на кожу, в глаза, а особенно в полость рта. | ||
Литература
1)Окислительно-восстановительные реакции: Методические указание для студентов нехимических специальностей. –Горький: Горьков. Политехнический университет. П.И. Шанина, Т.И. Молева. 1988 год.
2)Общая и неорганическая химия. Н.С.Ахметов. 2005 год.
3)Интернет ресурсы:
свободная интернет-энциклопедия “Википедия”(http://ru.wikipedia.org)
Нижегородский Государственный Технический Университет им. Р.Е. Алексеева
Кафедра «Органическая химия»
Лабораторная работа по теме
«Скорость химических реакций.
Химическое равновесие»
Выполнил: Студент гр. 11-МТ
Семаев Е.Д.
Проверил: Кутьин Александр
Павлович
Нижний Новгород
Год
Цель работы
Изучить скорость химических реакций и установить,от каких факторов она зависит в различных процессах.
Теоретический материал.
Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.

Реакции могут быть гомогенными и гетерогенными.
Гомогенные реакции протекают в однородной среде без каких-либо границ раздела между реагирующими веществами,к ним относятся процессы в газовой фазе или жидком растворе.Гомогенные реакции происходят равномерно во всем объеме.Скорость гомогенной химической реакции измеряется изменением концентрации одного из веществ,участвующих в процессеза единицу времени.
Гетерогенные реакции протекают в неоднородной среде,разделенной на отдельные части границами раздела;к ним относятся процессы между веществами,находящимися в разных фазах.Гетерогенные реакции происходят на границу раздела фаз.
Скорость реакций зависит от природы реагирующих веществ и от условий,в которых она протекает:концентрации,температуры,давления и присутствия катализатора.
Химические реакции подразделяют на элементарные и сложные. При элементарной реакции в системе протекает только один процесс и уравнение реакции раскрывает её механизм.При сложной реакции,уравнение является формальным,оно не отражает реальный механизм,а показывает лишь начальное и конечное состояние веществ.
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Основным законом химической кинетики является закон действия масс Гульдберга и Вааге. Он устанавливает соотношение между массами реагирующих веществ в химических реакциях приравновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакциипропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
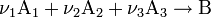
закон действующих масс может быть записан в виде кинетического уравнения вида:
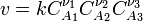
где  — скорость химической реакции,
— скорость химической реакции,  — константа скорости реакции.
— константа скорости реакции.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:

где 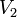 — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:

Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
§ Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
§ Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
§ Молекулы должны быть правильно ориентированы относительно друг друга.
Влияние этих факторов на скорость реакции может быть учтено при помощи так называемого серического фактора P:
A=PZ
A-предэкспоненциальный множитель,отвечающий общему числу соударений молекул Z, реагирующих веществ в единицу объема за единицу времени.
Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции  от температуры
от температуры  .
.

Катализатор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
Дата добавления: 2015-10-23; просмотров: 112 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Основная форма | | | Практическая часть |