
|
Читайте также: |
Поступив через воротную вену в печень, аминокислоты прежде всего подвергаются ряду превращений; друга ячасть разносится кровью по всему организму и используется для физиологических целей. В печени аминокислоты участвуют в синтезе собственных белков и белков плазмы крови, азотосодержащих соединений: пуриновых и пиримидиновых нуклеотидов, креатина, мочевой кислоты, НАД и др.
Как видно из схемы (рис. 20), всосавшиеся аминокислоты в первую очередь используются в качестве строительного материала для синтеза специфических тканевых белков, ферментов, гормонов и других биологически активных соединений. Некоторое количество аминокислот подвергается распаду с образованием конечных продуктов белкового обмена (СО2, Н2О, NН3) и освобождением энергии. Часть аминокислот претерпевает различные структурные превращения, которые носят как общий, так и частный характер. К общим реакциям превращений относятся реакции дезаминирования, переаминирования (трансаминирования) и декарбоксилирования.

Рис 20. Катаболизм аминокислот
Сущность реакций дезаминирования состоит в удалении аминогрупп кислот в виде свободного аммиака. Известно существование 4 типов дезаминирования:

Наиболее часто и активно протекают в органах и тканях животных реакции окислительного дезаминирования. Одной из важнейших в метаболизме аминокислот является глутаминовая кислота, дезаминирование которой катализирует глутаматдегидрогенеза. Она использует в качестве окислителя либо НАД+, либо НАДФ+:

Глутаматдегидрогеназа – ключевой фермент дезаминирования, участвует в окислении многих аминокислот.
Для других аминокислот не существует соответствующих дегидрогеназ. Их дезаминирование осуществляется по нескольким специальным механизмам, но большинство из них основано на переносе аминогрупп с аминокислот на a-кетоглутарат, в результате чего образуется соответствующая кетокислота и глутамат. Последний дезаминируется глутаматдегидрогеназой. Таким образом, дезаминирование других аминокислот протекает в две стадии: трансаминирования и дезаминирования.

Обе стадии – трансаминирование и дезаминирование - называют трансдезаминированием; ферменты, катализирующие трансаминирование, – трансаминазами, или аминотрансферазами.
Поскольку обе реакции обратимы, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие a-кетокислоты (однако кетокислоты соответствующих аминокислот не синтезируются в организме).
Образовавшиеся в процессе дезаминирования и трансдезаминирования
a-кетокислоты подвергаются в тканях животных различным превращениям и могут вновь трансдезаминироваться с соответствующей аминокислоты. Известны гликогенные, кетогенные и окислительные пути, ведущие к образованию соответственно глюкозы, жирных кислот, кетоновых тел и компонентов цикла трикарбоновых кислот.

Углеродные скелеты аминокислот могут включаться в ЦТК через ацетил-КоА, пируват, оксалоацетат, a-кетоглутарат и сукцинил-КоА. Пять аминокислот (Фен, Лиз, Лей, Трп, Тир) считаются «кетогенными», поскольку они являются предшественниками кетоновых тел, большинство других аминокислот являются «гликогенными» и служат в организме источником углеводов. Разделение аминокислот на «гликогенные» и «кетогенные» условно, поскольку отдельные участки Фен, Лиз, Трп, Тир могут включаться и в метаболиты, из которых потенциально может синтезироваться и глюкоза.
Процесс отщепления карбоксильной группы аминокислот в виде СО2 называется декарбоксилированием. В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. a-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с a-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:

2. w-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется a-аланин:

3. Декарбоксилирование, связанное с реакцией трансаминирования:
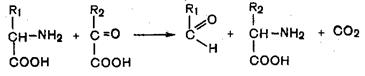
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:

Общим для всех этих реакций является выделение углекислого газа из карбоксильной группы аминокислоты и образование так называемых биогенных аминов (гистамин, серотонин и др.), обладающих важными биохимическими и физиологическими свойствами.
Накопление биогенных аминов может вызвать нарушение функций в организме. В организме биогенные амины обезвреживаются за счет реакций окислительного дезаминирования при участии ферментов оксидаз митохондрий.
Дата добавления: 2015-10-23; просмотров: 308 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Распад нуклеиновых кислот | | | Обезвреживание аммиака в организме |