
Читайте также:
|
Загальна характеристика d-елементів
1. Порівняйте зміну атомних радіусів, енергії іонізації та електронегативності елементів у головних та побічних підгрупах.
2. Чим пояснюється близькість атомних радіусів d-елементів V періоду та d-елементів VI періоду однієї групи?
3. Розгляньте особливості зміни основних характеристики атома для d-елементів ІІІ групи.
4. Чому більшість з d-елементів проявляють перемінну ступінь окиснення? Які з d-елементів проявляють постійну ступінь окиснення?
5. Як змінюється стійкість та окиснювальні властивості сполук d-елементів у вищих ступенях окиснення у підгрупах?
6. Розгляньте особливості хімії d-елементів у порівнянні з хімією s- та p-елементів.
7. Як змінюються кислотно-основні властивості гідроксидів одного й того ж d-елемента в залежності від ступеня окиснення?
8. Як змінюються кислотні властивості кислот d-елементів V-VIII груп у вищих ступенях окиснення?
9. Чим обумовлена висока схильність до комплексоутворення у d-елементів? Для яких з d-елементів вона проявляється у найбільшій (найменшій) мірі?
10. Які (катіонні або аніонні) форми більш характерні для d-елементів:
а) у нижчих ступенях окиснення;
б) у вищих ступенях окиснення?
Розв’яжіть задачі:
1. Визначте кількість суміші заліза з його сульфідом, при обробці якого розбавленою кислотою отримали газ об’ємом 3,984 дм3 (н. у.) з густиною за гелієм 2,6. Яка сіль і якої маси утворюється, якщо отриману газову суміш пропустити через розчин гідроксиду натрію масою 50 г з масовою часткою 4 %?
2. Суміш сірки та заліза масами 3,2 г і 6,0 г відповідно привели у взаємодію при нагріванні без доступу повітря. Отриманий продукт після розтирання обробили надлишком концентрованого розчину хлоридної кислоти. Який склад та об’єм (н. у.) отриманої в результаті газової суміші?
3. При нагріванні суміші заліза та цинку масами 11,2 г і 26,0 г відповідно з надлишком сірки та наступною обробкою продуктів реакції надлишком розчину хлоридної кислоти виділився газ, котрий пропустили через розчин сульфату міді (ІІ). Розрахуйте об’єм сульфату міді (ІІ) з масовою часткою 10 % (ρ=1,10 г/см3) витрачений на поглинання газу що утворився.
4. Суміш заліза, алюмінію та міді масою 5,0 г обробили надлишком розчину хлоридної кислоти, при цьому виділився водень об’ємом 1,900 дм3 (н. у.). При дії на цю суміш масою 3,0 г концентрованим розчином NaOH отримали водень об’ємом 0,672 дм3 (н. у.). Визначте склад початкової суміші (ω, %).
5. Визначте масову частку хрому у суміші хромату калію і дихромату калію, в якій масова частка калію дорівнює 35 %.
6. До 25 г 8 % - го розчину хлориду алюмінію прилили 25 г 8 % - го розчину гідроксиду натрію. Осад, що утворився, відфільтрували та прожарили. Визначте його масу та склад.
7. Яку масу галунів KAl(SO4)2·12H2O необхідно додати до 500 г 6 % - го розчину сульфату калію, щоб масова частка останнього збільшилась вдвічі? Найдіть об’єм газу (за н. у.) котрий виділиться при дії на отриманий розчин надлишку сульфіду калію.
8. Напишіть рівняння реакцій, що показують перехід від оксиду заліза (ІІІ) до хлориду заліза (ІІ).
9. Залізну пластину масою 5,2 г тривалий час витримували у розчині, який містить 1,6 г сульфату міді. По закінченню реакції пластину вийняли з розчину та висушили. Чому стала дорівнювати її маса?
10. Напишіть рівняння реакцій, що описують перетворення 
а) у кислому;
б) у лужному середовищі.
11. Напишіть повні рівняння реакцій, які відповідають наступній послідовності перетворень:
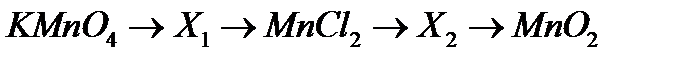 .
.
Визначте невідомі речовини.
12. Напишіть повні рівняння реакцій, що відповідають наступній послідовності перетворень:

Визначте невідомі речовини.
13. Напишіть рівняння реакцій, які відповідають наступній схемі (кожна стрілка позначує одну реакцію):

Визначте невідомі речовини.
14. Чому для отримання водню рекомендується обробляти цинк розбавленою хлоридною кислотою, а не сульфатною кислотою?
Список рекомендованої літератури
1. Кириченко В.І. Загальна хімія. – Київ: «Вища школа», 2005.
2. Ахметов Н. С. Общая и неорганическая химия. – М.: Высшая школа, 1988.
3. Любимова Н. Б. Вопросы и задачи по общей и неорганической химии. – М.: Высшая школа, 1990.
4. Глинка Н. Л. Задачи и упражнения по общей химии. – Л.: Химия, 1986.
5. Князев Д. А., Смарыгин С. Н. Неорганическая химия. – М.: Высшая школа, 1990.
6. Суворов А. В., Никольский А. Б. Общая химия. – СПб: Химия, 1994.
7. Гузей Л. С. Общая химия. – М.: Изд-во МГУ, 1988.
8. Хомченко Г. П. Неорганическая химия. – М.: Высшая школа, 1987.
ЗМІСТ
стор.
1. Теоретична частина 3
2. Експериментальна частина 8
3. Питання для самоконтролю 12
4. Задачі і вправи для самостійної роботи 18
5. Список рекомендованої літератури 21
6. Зміст 22
Дата добавления: 2015-10-26; просмотров: 131 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ | | | Microservice Architecture |