
Читайте также:
|
Бюретки на 25 мл.
Пипетки на 10, 100 мл.
Колбы конические для титрования на 250 мл, 3 шт.
Колбы мерные на 250 мл.
Соляная кислота HCl, 0,1 н раствор.
Бура Na2B4O7∙10 H2O.
Индикатор метиловый оранжевый, 0,1%-ный водный раствор.
1. Определение точной концентрации рабочего раствора HCl
по исходному веществу - буре Na2B4O7∙10H2O.
Приготовление стандартного раствора буры. При растворении буры в результате гидролиза образуется эквивалентное количество NaOH:
Na2B4O7 + 7H2O = 2NaOH + 4H3BO3.
Титр раствора буры Т и его нормальную концентрацию N рассчитывают по формулам


 г/мл;
г/мл;  ;
;
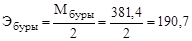 ,
,
где 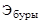 - эквивалент буры.
- эквивалент буры.
Титрование раствора HCl по буре. Бюретку заполните рабочим раствором HCl (~0,1н). Пипеткой отберите 10,00 мл приготовленного раствора буры, перенесите в коническую колбу для титрования, добавьте 1 - 2 капли индикатора - метилового оранжевого и отметьте окраску.
Колбу с раствором буры поставьте под бюретку с раствором соляной кислоты на лист белой бумаги. Одной рукой медленно (по каплям) добавляйте раствор HCl из бюретки (титруйте), а другой рукой непрерывно перемешивайте содержимое колбы круговыми движениями.
Титрование заканчивается при переходе окраски индикатора от желтой к бледно-оранжевой (окраске "чайной розы"). Если раствор приобрел розовый оттенок, то в колбу введен избыток кислоты. В этом случае содержимое колбы следует вылить, а опыт повторить.
Титрование проведите не менее трех раз и используйте средний результат для расчета:
 ; N2 =
; N2 =  ,
,
где V1 и N1 - объем (мл) и нормальная концентрация (экв/л) буры, а V2 и N2 - раствора HCl.
2. Определение карбонатной жесткости воды (контрольная задача).
Получите у преподавателя мерную колбу, содержащую образец раствора, карбонатную жесткость которого необходимо определить.
Раствор в мерной колбе разбавьте дистиллированной водой до метки, тщательно перемешайте.
Из мерной колбы отберите пипеткой 10,00 мл раствора в коническую колбу, добавьте 1 - 3 капли индикатора метилового оранжевого и титруйте из бюретки по каплям раствором HCl до изменения окраски индикатора от желтой до бледно-оранжевой.
Титрование проведите несколько раз и закончите, когда результаты анализов (по расходу кислоты) будут различаться не более чем на 0,2 мл.
Результаты определения и расчетов карбонатной жесткости запишите в форму табл.3.
Дата добавления: 2015-10-26; просмотров: 137 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Жесткость воды | | | Оборудование и реактивы |