
Железо
Степень токсичности железа низкая, но высокое содержание его в питьевой воде может вызывать разрушение центральной нервной системы, повышать восприимчивость организма к инфекциям, приводить к повреждению печени, болезням желудочно-кишечного тракта. Недостаток железа в организме ведет к анемии.
Источниками поступления железа в воду являются ржавые трубы, металлолом.
Предельно допустимая концентрация железа в воде - 5 мг/л (для  ).
).
Железо образует два ряда устойчивых солей: соли двухвалентного железа (содержат катион 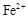 ) и соли трехвалентного железа (содержат катион
) и соли трехвалентного железа (содержат катион  ). На воздухе катион
). На воздухе катион 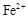 быстро окисляется до
быстро окисляется до  , поэтому в природных водах содержатся в основном соли железа (III). Они имеют желтую или красно-бурую окраску. Поэтому такая окраска воды позволяет предположить наличие в ней катионов железа.
, поэтому в природных водах содержатся в основном соли железа (III). Они имеют желтую или красно-бурую окраску. Поэтому такая окраска воды позволяет предположить наличие в ней катионов железа.
Опыт 6. Определение железа (III)
А) Определение роданидом аммония NH4CNS.
При добавлении к раствору соли железа (III) роданида аммония образуется роданид железа кроваво-красного цвета
 .
.
Это одна из важнейших и наиболее чувствительных реакций для обнаружения катионов железа (III) в воде. Однако она не всегда надежна, так как присутствие фторидов, фосфатов, оксалатов, цитратов, а также солей винной кислоты препятствует ее протеканию.
Добавьте в раствор, содержащий несколько капель соли железа (III), 1 - 2 капли раствора NH4CNS. Отметьте цвет раствора. Напишите уравнение реакции.
Б) Определение гексацианоферратом (II) калия.
Гексацианоферрат (II) калия образует с катионами железа (III) темно-синий осадок "берлинской лазури"
 .
.
Добавьте в раствор, содержащий соль железа (III), 2 - 3 капли раствора гексацианоферрата (II) калия. Отметьте цвет образовавшегося осадка. Напишите уравнение реакции.
Хром
Соединения этого металла обладают средней степенью токсичности. Предполагается наличие канцерогенных свойств.
Источниками поступления хрома в воду являются сточные воды гальванического производства, продукты коррозии хромсодержащих сталей, краски, отходы некоторых химических производств.
Предельно допустимая концентрация соединений хрома в воде составляет 0,05 мг/л.
Дата добавления: 2015-10-26; просмотров: 237 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Б) Взаимодействие с иодидом калия . | | | Опыт 7. Определение хрома |