
Читайте также:
|
Известно, что многие химические реакции не доходят до конца, т. е. исходные вещества не расходуются полностью на образование продуктов реакции. В этом случае система находится в состоянии динамического равновесия, с течением времени при определенных условиях скорость прямой реакции становится равной скорости обратной реакции. При неизменности внешних условий система находится в состоянии равновесия сколь угодно долго, при этом с термодинамической точки зрения соотношение концентраций исходных веществ и продуктов реакции поддерживается постоянным и отвечает минимальному значению свободной энергии Гиббса. Постоянство состава системы может служить признаком, достаточным для констатирования наступления равновесия, лишь для реакций, протекающих сравнительно быстро. Для реакций, протекающих с незначительной скоростью, состав смеси может оставаться постоянным продолжительное время и состояние равновесия оказывается кажущимся. Для установления равновесия необходимо воспользоваться вторым признаком равновесия - признаком его подвижности. Если система, находящаяся в состоянии равновесия, будет выведена из этого состояния под действием внешних факторов (температура, давление), то после прекращения этих воздействий она самопроизвольно должна вернуться в прежнее состояние. Однако, если этого не происходит, то система не достигла еще состояния равновесия. Поэтому состояние химического равновесия характеризуется двумя признаками: постоянством состава при данных внешних условиях и подвижностью. Состав равновесной смеси характеризуется тем, что в ней концентрации исходных веществ и продуктов реакции находятся в определенном соотношении, которое определяется константой равновесия.
Для реакции аА + вВ = еЕ + fF при равновесии скорость прямой реакции равна скорости обратной реакции и константа равновесия (Кс) может быть представлена соотношением:

| (2.1) |
где С - равновесные мольные концентрации веществ; а, в, с, f - стехиометрические коэффициенты.
Константу равновесия можно выразить через равновесные парциальные давления компонентов системы:
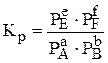
| (2.2) |
Связь между Кр и Кс описывается уравнением Кр = Кс(RT)Dn.
Учение о химическом равновесии позволяет рассчитывать выход продуктов реакции и раскрывает возможности управления химическими процессами. Следует помнить, что равновесие системы может смещаться при изменении концентрации реагирующих веществ, давления и температуры, константа же равновесия зависит только от температуры. Данная зависимость описывается уравнением изобары (2.3) или изохормы (2.4) Вант-Гоффа:
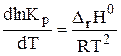
| (2.3) | |

| (2.4) |
где DrН0 - изменение энтальпии, DrU0 - изменение внутренней энергии системы.
Для химических реакций DrН0 и DrU0 соответствуют тепловому эффекту реакций соответственно при р = const и v = const. Знак теплового эффекта определяет зависимость константы равновесия от температуры. Если DrН0 > 0, то реакция эндотермическая, знак производной dlnKp/dT будет положительный, следовательно, с увеличением температуры константа равновесия эндотермической реакции возрастает. При этом равновесие может смещаться в сторону образования продуктов реакции.
Если принять, что тепловой эффект химической реакции не зависит от температуры,то уравнение Вант-Гоффа можно представить в интегральной форме (уравнения 2.5 и 2.6):
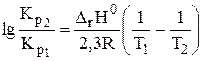
| (2.5) | |

| (2.6) |
где В - постоянная интегрирования.
На основании уравнения (2.6) можно определить тепловой эффект реакции графическим методом, зная константы равновесия при 4 - 5 температурах (рис. 1).
|
tg (p - a)  tg a = -tg (p - a) = -
tg a = -tg (p - a) = -  D rH0 = 2,3R tg (p - a) =- 2,3R tg a
D rH0 = 2,3R tg (p - a) =- 2,3R tg a
|
Рис. 1. Зависимость lg Kp от обратной температуры.
Для определения направления протекания химической реакции при заданных значениях температуры и давления используют уравнение изотермы химической реакции (2.7):
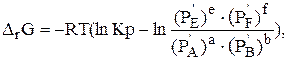
| (2.7) |
где DrG - изменение изобарно-изотермического потенциала системы при реакции,  ,
, 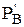 ,
,  ,
,  - исходные парциальные давления участников реакции, Кр - константа равновесия, выраженная через равновесные парциальные давления компонентов.
- исходные парциальные давления участников реакции, Кр - константа равновесия, выраженная через равновесные парциальные давления компонентов.
Если DrG реакции < 0, то при данной температуре и заданных исходных парциальных давлениях участников реакции процесс будет протекать самопроизвольно. Если DrG=0, то реакция при этих условиях достигает состояния равновесия. При стандартных условиях, когда исходные парциальные давления равны 1 атм ( =
= 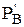 =
=  =
=  = 1 атм), уравнение изотермы имеет вид:
= 1 атм), уравнение изотермы имеет вид:
DrG0 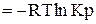
| (2.8) |
Тогда в общем виде можно записать:
DrG  DrG0 DrG0 
| (2.9) |
Из этого уравнения видно, что если при стандартных условиях DrG0 > 0, то это не свидетельствует о том, что реакция не пойдет. Можно подобрать такое соотношение исходных парциальных давлений и концентраций, при которых DrG станет меньше нуля и реакция будет протекать самопроизвольно.
Дата добавления: 2015-10-31; просмотров: 73 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Таким образом, энтропия может служить критерием самопроизвольности процессов и равновесия в изолированных системах. | | | Полное Восстановление |