
Читайте также:
|
АДСОРБЦИЯ
А.1 Общие сведения
Адсорбцией называется процесс поглощения одного или нескольких компонентов из газовой, парогазовой или жидкой смеси твердым поглотителем, называемым адсорбентом. В данном разделе будет рассматриваться адсорбция из газовой фазы, однако все рассуждения и соотношения, за исключением (А.2а), применимы для адсорбции из жидкой смеси.
Адсорбируемое вещество, находящееся в газе, называется адсорбтивом, а после его перехода в фазу адсорбента - адсорбатом.
Процессы адсорбции избирательны и обычно обратимы. Благодаря их обратимости становится возможным выделение поглощенных веществ из адсорбента (десорбция).
Адсорбция применяется главным образом при небольших концентрациях поглощаемого вещества в исходной смеси, когда требуется достичь практически полного извлечения адсорбтива. В тех случаях, когда концентрация извлекаемого вещества в исходной смеси велика, обычно выгоднее использовать абсорбцию.
В промышленности процессы адсорбции используются при очистке и осушке газов, в частности при извлечении паров летучих растворителей из их смеси с воздухом и другими газами (рекуперация летучих растворителей).
Способность твердых тел поглощать вещества из газовой фазы объясняется особыми свойствами молекул поверхности твердого тела. Их силовые поля в противоположность силовым полям молекул, расположенных в объеме твердого тела в окружении других молекул, не уравновешены, в результате чего возникает сила, направленная к поверхности твердого тела (сила притяжения). Под действием этой силы и происходит притяжение молекул из газовой фазы. В зависимости от природы сил, действующих на поверхности твердого тела, различают физическую и химическую адсорбцию. Последнюю обычно называют хемосорбцией.
Физическая адсорбция происходит под действием сил взаимного притяжения молекул газа молекулами на поверхности твердого тела - вандерваальсовскими силами. Действие ваандервальсовских сил проявляется на расстояниях, значительно превышающих размеры адсорбируемых молекул газа. Поэтому при физической адсорбции на поверхности адсорбента обычно удерживается несколько слоев молекул поглощаемого вещества.
При химической адсорбции, или хемосорбции, в результате химической реакции между молекулами поглощенного газа и поверхностными молекулами адсорбента возникает химическая связь.
Важнейшими характеристиками адсорбента являются поглотительная способность и селективность. Под поглотительной способностью понимается количество вещества, которое может быть поглощено единицей массы или объема адсорбента, а под селективностью - избирательная способность поглощения целевых компонентов (или компонента) из разделяемой газовой смеси.
А.2 Виды адсорбентов и их характеристики
В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы - поры, которые условно могут быть разделены на макропоры (более 2·10-4 мм), переходные поры (6·10-6 - 2·10-4 мм), микропоры (2·10-6 - 6·10-6 мм). Характер процесса адсорбции определяется размером пор.
Удельная поверхность макропор относительно мала, поэтому на их поверхности (стенках) адсорбируется небольшое количество вещества. Макропоры играют, в основном, роль транспортных каналов для адсорбируемых молекул газа.
На поверхности переходных пор, размеры которых значительно больше размеров адсорбируемых молекул, в процессе адсорбции образуются слои поглощенного вещества. Возможно образование слоев толщиной в одну молекулу (мономолекулярная адсорбция) и в несколько молекул (полимолекулярная адсорбция).
Размеры микропор приближаются к размерам адсорбируемых молекул, и адсорбция в микропорах приводит к заполнению их объема. Вследствие этого говорить об образовании слоев поглощенного вещества на поверхности микропор не имеет смысла. Обычно микропоры пересекаются макро - и переходными порами, что сокращает путь, проходимый адсорбируемыми молекулами, и приводит к ускорению адсорбции.
Адсорбенты характеризуются своей поглотительной или адсорбционной способностью, определяемой концентрацией поглощенного вещества в единице массы или объема адсорбента.
Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, а также от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента называется его равновесной активностью.
В промышленности в качестве адсорбентов применяются главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.), а также синтетические ионообменные смолы (иониты).
Активные угли. Высокопористые активные угли получают путем сухой перегонки различных углесодержащих веществ (дерево, костей и др.) и активирования полученных углей для повышения их пористости. Удельная поверхность активных углей колеблется от 600 до 1700 м2/г. Размер гранул некоторых стандартных марок активных углей для адсорбции газов составляет 1-5 мм (уголь БАУ) и 1,5 – 2,7 мм (уголь СКТ). Насыпная плотность углей этих марок равна 260 и 420 кг/м3 соответственно. Применение углей того или иного вида зависит от разновидности процесса адсорбции, в котором они используются (поглощение газов, рекуперация летучих растворителей и т.д.). Недостатком активных углей является их горючесть; в воздухе они возгораются при температуре около 300 С°.
Силикагели. Это минеральный адсорбент, представляющий собой гидратированный гель кремневой кислоты (SiO2х n H2O), получаемый действием серной кислоты или растворов солей, имеющих кислую реакцию, на раствор силиката натрия. Выделяющийся гель после промывки водой сушат до конечной влажности 5-7%, при которой достигается наибольшая адсорбционная способность. Силикагель отличается однородностью и равномерным распределением пор, средние диаметры которых лежат в пределах от 1,5 до 5×10-6 мм. Удельная поверхность силикагеля изменяется от 400 до 770 м2/г. Размер гранул колеблется от 0,2 до 7 мм, насыпная плотность составляет 400 - 800 кг/м3.
Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей.
Цеолиты. Эти адсорбенты являются природными или синтетическими минералами (алюмосиликаты щелочных металлов). В качестве промышленных адсорбентов применяются главным образом синтетические цеолиты, обладающие весьма однородной структурой пор, размеры которых соизмеримы с размерами адсорбируемых молекул. Эти цеолиты проявляют молекулярно-ситовое действие, которое заключается в их способности не поглощать молекулы,
диаметр которых больше диаметра пор.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и их часто используют для глубокой осушки газов, содержащих небольшие количества влаги. Размеры гранул цеолитов составляют от 2 до 5 мм.
А.3 Равновесие при адсорбции
Количество вещества, адсорбированное единицей массы или объема адсорбента при достижении состояния равновесия, зависит от температуры и концентрации поглощаемого вещества в газовой смеси. Эта зависимость запишется в виде:
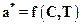 , (А.1)
, (А.1)
или при постоянной температуре (Т = const)
 , (А.2)
, (А.2)
где a* - концентрация поглощаемого вещества в адсорбенте, равновесная с концентрацией его в газовой фазе, кг адсорбата/м3 адсорбента; С - концентрация адсорбтива в газовой фазе, кг адсорбтива/м3.
Концентрация С поглощаемого вещества может быть заменена его парциальным давлением pА в газовой смеси. Тогда изотерма адсорбции примет вид
 . (А.2а)
. (А.2а)
Изотермы адсорбции определяются опытным путем. Вид изотермы адсорбции зависит от многих факторов: удельной поверхности адсорбента, объема пор, их распределения по размерам, а также от температуры проведения процесса. В качестве примера на рис. А.1 приведены виды типичных изотерм адсорбции для различных веществ, на рис. А.2 - изотермы адсорбции для одного вещества при различных температурах его проведения.
 Рис. А.1 Изотермы адсорбции для
различных веществ:
1 – выпуклая, 2 – вогнутая, 3 - линейная
Рис. А.1 Изотермы адсорбции для
различных веществ:
1 – выпуклая, 2 – вогнутая, 3 - линейная
| 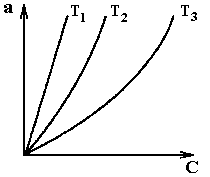 Рис. А.2 Изотермы адсорбции для одного вещества при различных температурах:
Т1<Т2<Т3
Рис. А.2 Изотермы адсорбции для одного вещества при различных температурах:
Т1<Т2<Т3
|
Адсорбция сопровождается уменьшением парциального давления поглощаемого компонента из газовой смеси и заметным выделением тепла. Поэтому, в соответствии с принципом Ле-Шателье, количество адсорбированного вещества возрастает с понижением температуры и повышением давления. Из этого следует, что повышение температуры и понижение давления отрицательно влияют на процесс адсорбции, способствуя десорбции поглощенного вещества из адсорбента.
Дата добавления: 2015-10-24; просмотров: 204 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Physics and Chemistry of Extreme UV Multilayer Optics | | | А.4 Кинетика периодической адсорбции |