
|
Читайте также: |
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию. Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-ЙоркеКонрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia». Самый долгоживущий гальванический элемент - серно-цинковая батарея, изготовленная в Лондоне в 1840 г. Подключенный к ней звонок работает и по сей день в Кларендонской Лаборатории Оксфорда.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде.
Энергия возникает в результате взаимодействия оксида свинца и серной кислоты до сульфата (классическая версия). Проведенные в СССР исследования показали, что внутри свинцового аккумулятора протекает как минимум ~60 реакций, порядка 20 из которых протекают без участия кислоты электролита (нехимические) [1]
Во время разряда происходит восстановление диоксида свинца на катоде [2][1] и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева направо — разряд, справа налево — заряд):
· Анод:

· Катод:
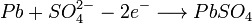
В итоге получается, что при разряде аккумулятора расходуется серная кислота из электролита (и плотность электролита падает, а при заряде, серная кислота выделяется в раствор электролита из сульфатов, плотность электролита растёт). В конце заряда, при некоторых критических значениях концентрации сульфата свинца у электродов, начинает преобладать процесс электролиза воды. При этом на катоде выделяется водород, на аноде — кислород. При заряде не стоит допускать электролиза воды, в противном случае необходимо её долить для восполнения потерянного в ходе электролиза количества.
Щелочной На аноде проходят реакции окисления цинка. Вначале образуется гидроксид цинка:
Zn + 2OH− → Zn(OH)2 + 2e−
Который затем разлагается на оксид цинка и воду.
Zn(OH)2 → ZnO + H2O
На катоде, в свою очередь, происходят реакции восстановления оксида марганца (IV) в (III):
2MnO2 + H2O + 2e− → Mn2O3 + 2OH−
В целом, химические процессы внутри элемента при использовании KOH в качестве электролита можно описать следующим уравнением:
Zn + 2KOH + 2MnO2 + 2e− → 2e− + ZnO + 2KOH + Mn2O3
Как видим, в отличие от солевого элемента, в щелочном электролит в процессе разрядки батареи практически не расходуется, а значит достаточно малого его количества. Поэтому, в щелочном элементе в среднем в 1,5 раза больше диоксида марганца.
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне [1] — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе. Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимическое устройство в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию.
Естественным топливным элементом является митохондрия живой клетки. Митохондрии перерабатывают органическое «горючее» — пируваты и жирные кислоты, синтезируя АТФ — универсальный источник энергии для всех биохимических процессов в живых организмах, одновременно создавая разность электрических потенциалов на своей внешней мембране. Однако, копирование этого процесса для получения электроэнергии в промышленных масштабах лишено смысла, т.к. на долю электрической разности потенциалов приходятся ничтожная доля химической энергии исходных веществ: почти вся энергия передаётся молекулам АТФ.
Дата добавления: 2015-09-01; просмотров: 64 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Альванический элемент. ЭДС гальванического элемента | | | Электролиз расплавов и растворов электролитов. Электролиз с инертным и растворимым анодом. |