
Читайте также:
|
Реакции нуклеофильного замещения для пиридиниевого цикла наиболее характерны. Пиридиниевый атом азота оказывает на ядро активирующее действие, подобно нитрогруппе в бензольном кольце. Нуклеофильное замещение протекает по механизму присоединения-отщепления (SNAr). Наиболее активированными являются положения 2 и 4.
В хинолине к нуклеофильному замещению также активированы положения 2 и 4.
Под действием таких сильных нуклеофилов, как амиды металлов и металлоорганические соединения, в пиридине и хинолине возможно замещение гидрид-иона. Аминирование пиридина и хинолина амидами металлов носит название реакции Чичибабина. Процесс проводят путем нагревания реагентов в инертном растворителе. Механизм реакции – присоединение –отщепление.
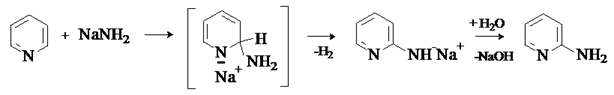
Аналогично реагирует хинолин с образованием 2-аминохинолина.
При действии на пиридин и хинолин фениллития водород в положении 2 замещается на фенильную группу.

Понятие о металлорганических соединениях. Характеристика связей углерод-элемент в зависимости от положения элемента в Периодической системе элементов. Реакция Гриньяра и ее механизм. Комплексы переходных металлов. Строение комплексов. Типы превращения комплексов переходных металлов. Их роль в катализе органических соединений.
Металлоорганическими соединениями называют такие производные углеводородов, в которых один из атомов водорода замещен металлом С - М. Например, диметилцинк (CH3)2Zn, диэтилцинк (C2H3)2Zn.Чаще всего М = Na, Li, Pb, Mg, Cd, Hg, Al Номенклатура: C4H9Li – бутиллитий CH3MgI – метилмагний иодид (С2H5)2Hg – диэтилртуть (C2H5)3Al –триэтилалюминий (C2H5)2AlH – диэтилалюминий гидрид Связь в металлорганических соединениях может изменяться от практически ионной (сильно электроположительный К) до практически ковалентной (олово, ртуть).
Химическая связь «элемент — углерод» металлорганических соединениях бывает как полярной (ионной), так и неполярной. Металлы, катионы которых имеют малый объем и большой заряд, образуют ковалентные связи; так возникают ртутьорганические соединения и соединения элементов IV и V групп. Металлы, легко отдающие электроны, т. е. имеющие большой объем и малый заряд ядра, например щелочные металлы, образуют ионные связи, в которых атом углерода C несет отрицательный заряд −>C−-M+ (M — атом металла). Наличие отрицательного заряда на атоме углерода таких соединений позволяет использовать их как катализаторы реакций полимеризации при получении синтетических каучуков. С помощью металлоорганических соединений алюминия и титана получают полиэтилен, полипропилен и другие полимеры.
Все металлорганические можно подразделить на две группы:
1. Металлорганические соединения непереходных и часть переходных металлов. Эти соединения содержат одинарную (σ) связь металл — углерод.
2. Металлорганические соединения переходных металлов (в том числе карбонилы металлов), построенные путём заполнения s-, p- и d-орбиталей атома металла p-электронами различных ненасыщенных систем, например ароматических, олефиновых, ацетиленовых, аллильных, циклопентадиенильных.
Из металлорганических соединений 1-й группы наиболее полно изучены производны Li, Na, К, Be, Mg, Zn, Cd, Hg, B, Al, Tl, Ge, Sn, Pb, As и Sb. Свойства этих соединений определяются характером связи М—С (М — атом металла), зависящей главным образом от природы металла, а также от характера и числа органических радикалов, связанных с атомом металла.
В металлорганических соединениях щелочных металлов связь М—С сильно поляризована, причём на атоме металла сосредоточен частичный положительный, а на атоме углерода — частичный отрицательный заряд: Поэтому такие соединения весьма реакционноспособны: они энергично разлагаются водой и очень чувствительны к действию кислорода. Аналогичные свойства присущи соединениям щёлочноземельных металлов (Mg, Ca), а также Zn, Cd, В и Al. Например, такие вещества, как (CH3)2Zn, (CH3)3B, (C2H5)3Al, воспламеняются на воздухе.
Дата добавления: 2015-08-27; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Реакции присоединения | | | Реакция Гриньяра и ее механизм. |