
Читайте также:
|
Перициклическими называются реакции ненасыщенных молекул, которые протекают через циклическое переходное состояние. Таких реакций в органической химии очень много, и обычно их подразделяют на три основные группы, перечисленные ниже. 1. Циклоприсоединение - циклораспад. Наиболее известным из процессов циклоприсоединения является реакция Дильса-Альдера (см гл. 7), в ходе которой молекула, содержащая цис-1,3-бутадиеновый фрагмент, реагирует с другой молекулой (диенофилом), содержащей этиленовый фрагмент. В результате образуется шестичленный цикл (циклоприсоединение [2+4]).
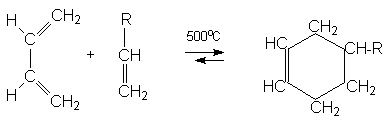
Такие реакции называются диеновым синтезом или реакцией Дильса-Альдера. Соединения, содержащие двойную или тройную связь и вступающие с 1,3–алкадиенами в реакцию диенового синтеза называются диенофилами. Реакционная способность диенофилов увеличивается при активировании их кратной связи электроноакцепторными группами.
В реакции Дильса-Альдера происходит исчезновение трех старых p -связей и появление новых: одной p -связи и двух s -связей. Поскольку прочность s -связей существенно выше, чем прочность p -связей, реакция Дильса-Альдера экзотермична. Это обусловливает ее обратимость при высоких температурах.
14. Гетероциклические соединения. Классификация. Пятичленные и шестичленные гетероциклические соединения: фуран, пиррол, тиофен, пиридин, хинолин. Пространственное и электронное строение. Ароматичность. Реакции электрофильного и нуклеофильного замещения.
Гетероциклические соединения – это органические вещества, содержащие в своих молекулах циклы, в образовании которых кроме атомов углерода участвуют атомы других элементов (гетероатомы).
Для классификации гетероциклических соединений используют следующие признаки.
· по размеру цикла гетероциклические соединения бывают чаще всего трех-, четырех-, пяти-, шести- и семичленными:

· по типу элемента, входящего в состав цикла, это главным образом соединения с атомами азота, кислорода или серы:

· по числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с одним и двумя гетероатомами, но известны соединения и с четырьмя атомами в одном цикле:

· по природе и взаимному расположению нескольких гетероатомов возможны разнообразные комбинации (например, N и S, N и O и т.д.), причем гетероатомы могут занимать различные положения относительно друг друга:
· по степени насыщенности гетероциклы могут быть ароматическими, ненасыщенными и насыщенными:
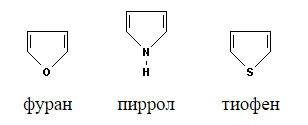
Ароматичность.
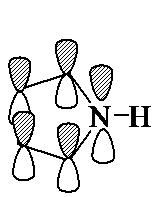
Пиррол, фуран и тиофен могут быть отнесены к ароматическим соединениям, так как их молекулы содержат циклическую сопряженную систему, включающую 6 p-электронов. Они являются электронными аналогами ароматического карбоцикла – циклопентадиенил-аниона. В молекуле пиррола атом азота находится в состоянии sp2-гибридизации и образует три s-связи, лежащие в плоскости кольца. р-Орбиталь атома азота со свободной парой электронов взаимодействует с четырьмя р-орбиталями атомов углерода с образованием циклическойp-системы, содержащей секстет p-электронов.
Атом азота в пирроле действует как электронодонор по мезомерному механизму, поэтому p-электронная плотность на атомах углерода пиррола повышена по сравнению с бензолом. Такие гетероциклы называют p -избыточными (на пять атомов приходится шесть p-электронов).
Гетероциклы фуран и тиофен имеют аналогичную p-систему, в которой одна из неподеленных пар электронов кислорода и серы соответственно участвуют в образовании ароматического секстета. Фуран и тиофен также относятся к p - избыточными гетероциклическим соединениям.
Подтверждением ароматического характера пиррола, фурана и тиофена является их плоское строение и длины связей, которые имеют промежуточные значения между обычными простыми и двойными связями С-С, C-N, C-O и C-S. Эмпирические оценки и квантово-механические расчеты показывают, что пятичленные гетероциклы стабилизированы за счет делокализации p-электронов, однако энергияделокализации у них ниже, чем у бензола. В наименьшей степени стабилизирован фуран, который, таким образом, обладает меньшей ароматичностью, чем пиррол и тиофен.
Пиррол С4H4NН – пятичленный гетероцикл с одним атомом азота.
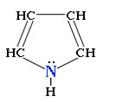
Электронное строение молекулы пиррола объясняет его свойства как слабой кислоты и ароматического соединения.
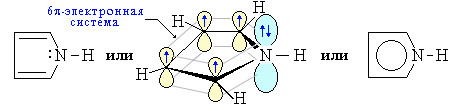
Атомы углерода и азота находятся в состоянии sp 2-гибридизации σ-Связи C–C, C–H и C–N образованы гибридными орбиталями. Цикл имеет плоское строение. На негибридной р -орбитали азота находится неподеленная пара электронов, которые вступают в сопряжение с четырьмя р -электронами атомов углерода. Таким образом, в циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола.
Пиррол значительно активнее бензола в реакциях электрофильного замещения, т.к. атом азота, предоставляя в систему сопряжения два электрона (+ М -эффект), повышает электронную плотность в цикле.
Пример - замещение 4-х атомов водорода при иодировании:
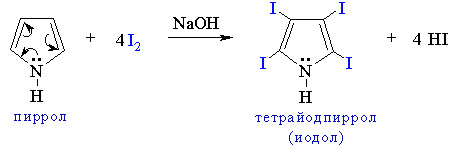
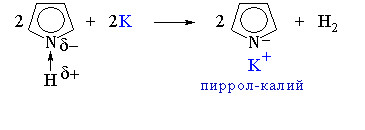
Связывание неподеленной электронной пары атома азота системой сопряжения приводит к резкому ослаблению основных и проявлению кислотных свойств. Как слабая кислота пиррол вступает в реакцию с металлическим калием, образуя соль – пиррол-калий:
Пиррол может участвовать в реакциях присоединения:
- гидрирование приводит к образованию пирролидина

- под действием сильных минеральных кислот пиррол вступает в реакции полимеризации.
Дата добавления: 2015-08-27; просмотров: 101 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Реакции 1,3-алкадиенов. | | | Реакции электрофильного замещения |