
Читайте также:
|
Гидрирование.
Пиррол, фуран и тиофен присоединяют водород в условиях каталитического гидрирования с образованием тетрагидропроизводных.
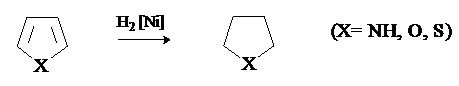
Труднее других гидрируется тиофен, который отравляет катализатор. Особенностью химии тиофена является восстановительнаядесульфуризация, которая используется в синтетических целях для получения соединений, трудно доступных другими методами.
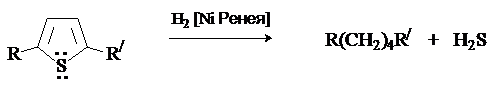
Реакция Дильса-Альдера
Реакции циклоприсоединения характерны для фурана, который в большей степени, чем пиррол и тиофен, проявляет свойства сопряженного диена. Например, он вступает при комнатной температуре в реакцию диенового синтеза с таким активным диенофилом, как малеиновый ангидрид.

Пиридин.
Пиридин С5H5N – шестичленный гетероцикл с одним атомом азота.
Это бесцветная жидкость с неприятным запахом, т.кип. 115°С. Хорошо растворяется в воде и органических жидкостях. Ядовит.
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp 2-гибридизации. Все σсвязи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют π-электронную ароматическую систему.
Из трех гибридных орбиталей атома азота две образуют σ-связи С–N, а третья содержит неподеленную пару электронов, которые не участвуют в π-электронной системе. Поэтому пиридин, подобно аминам, проявляет свойства основания. Его водный раствор окрашивает лакмус в синий цвет. При взаимодействии пиридина с сильными кислотами образуются соли пиридиния.
Наряду с основными свойствами пиридин проявляет свойства ароматического соединения. Однако его активность в реакциях электрофильного замещения ниже, чем у бензола. Это объясняется тем, что азот как более электроотрицательный элемент оттягивает электроны на себя и понижает плотность электронного облака в кольце, в особенности в положениях 2, 4 и 6 (орто - и пара -положения).
Реакции электрофильного замещения в пиридине идут с большим трудом, что обусловлено p-дефицитностью ядра и способностью атома азота образовывать соли с протонными кислотами и комплексы с кислотами Льюиса, что еще больше уменьшает нуклеофильность ядра. По реакционной способности к электрофильному замещению пиридин напоминает нитробензол.

Пиридин нитруется, сульфируется и галогенируются в очень жестких условиях. Только процессы галогенирования и сульфирования идут с удовлетворительными выходами. Алкилирование и ацилирование в кольцо провести не удается.
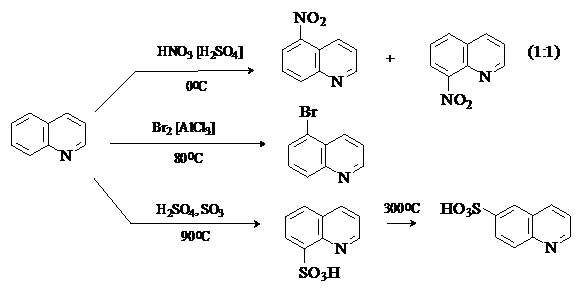
Хинолин. Представляет собой конденсированное гетероциклическое соединение, в состав которого входят бензольное и пиридиновое ядра, имеющие общее сочленение. Хинолин по свойствам подобен пиридину: проявляет основный характер, при действии алкилгалогенидов образует четвертичные хинолиниевые соли.
Реакции электрофильного замещения идут по наименее электронодефицитному бензольному кольцу преимущественно в положения 5 и 8. В условиях термодинамического контроля, например, при сульфировании выше 3000С, основным продуктом будет более стабильный 6-изомер.
Дата добавления: 2015-08-27; просмотров: 59 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Реакции электрофильного замещения | | | Реакции нуклеофильного замещения. |