
Читайте также:
|
Количественно селективность катализатора можно оценить как селективность процесса — интегральную или дифференциальную. Если одновременно протекает несколько параллельных реакций, то можно подобрать разные селективные катализаторы для каждой из них реакций. Например, в присутствии оксида алюминия или оксида тория этанол разлагается преимущественно на этилен и воду:

И присутствии серебра, меди и других металлов практически имеет место только реакция дегидрирования спирта с образованием уксусного альдегида:

в присутствии смешанного катализатора (А 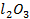 + ZnO) с достаточно высокой селективностью идут реакции дегидратации и дегидрирования с образованием бутадиена:
+ ZnO) с достаточно высокой селективностью идут реакции дегидратации и дегидрирования с образованием бутадиена:
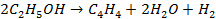
Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, от области протекания гетерогенно-каталитического процесса (кинетической, внешне- или внутреннедиффузиознной и т. д.
Пористая и кристаллическая структура катализатора. Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему); удельной поверхностью катализатора (т.е. приходящейся на единицу массы или объема).
При выборе твердого вещества, которое должно служить активным катализатором для гетерогенных газовых реакций, важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, иначе внешняя поверхность, весьма небольшая, быстро подвергалась бы отравлению, и катализатор вскоре утрачивал бы активность. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы характеризуются большими значениями удельной поверхности — до 10  100 м2/г.
100 м2/г.
Однако распределение пор по размерам может оказаться таким, что часть поверхности катализатора окажется совершенно недоступной для реагирующих молекул большого размера и, кроме того, скорость превращения реагентов в конечные продукты может уменьшаться вследствие затруднения диффузии реагентов внутри пор.
Для получения катализаторов с развитой пористой структурой используют специальные методы их приготовления. Стараются применять в качестве катализаторов природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т.д.); эти вещества употребляют также как носители, на поверхность которых наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью. Например, переход γ-  в
в  на несколько порядков снижает активность этого вещества как катализатора дегидрирования.
на несколько порядков снижает активность этого вещества как катализатора дегидрирования.
Промотирование и отравление катализаторов. Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором — об отравлении катализатора.
Механизм промотировании твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью; они могут изменить условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличить дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т.п.
Например, каталитическая активность  по отношению к реакции окисления диоксида серы повышается в сотни раз при добавлении небольших количеств сульфатов щелочных металлов; введение 2—3%
по отношению к реакции окисления диоксида серы повышается в сотни раз при добавлении небольших количеств сульфатов щелочных металлов; введение 2—3% 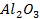 в катализатор синтеза аммиака позволяет создать стабильную геометрическую структуру, не меняющуюся под воздействием реакционной среды в течение длительного времени.
в катализатор синтеза аммиака позволяет создать стабильную геометрическую структуру, не меняющуюся под воздействием реакционной среды в течение длительного времени.
Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами. Например, если в газе, поступающем для окисления  на ванадиевом катализаторе, содержание
на ванадиевом катализаторе, содержание  составляет 4—5 мг/м3, происходит резкое снижение каталитической активности.
составляет 4—5 мг/м3, происходит резкое снижение каталитической активности.
Это объясняется в соответствии с теорией активных центров, согласно которой каталитическую активность проявляет не вся поверхность катализатора, а лишь некоторые ее участки, обладающие определенным энергетическим и геометрическим соответствием реагирующим молекулам — активные центры. Каталитические яды блокируют эти активные центры, образуя с ними поверхностные химические соединения.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается. Одно и то же вещество может вызвать и обратимое и необратимое отравление, в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса.
Например, для железного катализатора синтеза аммиака каталитическими ядами являются кислород и кислородсодержащие соединения (СО, С02, Н20). При содержании 1  10-2 % СО в газовой смеси, поступающей на катализатор, работающий при давлении 30 МПа.и температуре 450° С, через 6 сут активность катализатора уменьшается на 25 %; его активность можно полностью восстановить за 1 сут. работы с чистым газом. При содержании 5 10-2 % СО в исходном сырье через 3 сут активность катализатора падает на 67 %, а через 4 сут работы на чистом газе полностью восстанавливается. При 500 °С и содержании 5
10-2 % СО в газовой смеси, поступающей на катализатор, работающий при давлении 30 МПа.и температуре 450° С, через 6 сут активность катализатора уменьшается на 25 %; его активность можно полностью восстановить за 1 сут. работы с чистым газом. При содержании 5 10-2 % СО в исходном сырье через 3 сут активность катализатора падает на 67 %, а через 4 сут работы на чистом газе полностью восстанавливается. При 500 °С и содержании 5  10-3 % O2 концентрация NH3 в газе на выходе падает на 4 % и применение чистого газа уже не восстанавливает прежнюю активность катализатора.
10-3 % O2 концентрация NH3 в газе на выходе падает на 4 % и применение чистого газа уже не восстанавливает прежнюю активность катализатора.
С целью удлинения срока службы катализатора в промышленных условиях в технологических схемах предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами (например, в производстве серной кислоты — от соединений мышьяка и фтора, в производстве аммиака — от СО, С02, сернистых соединений и т. д.).
В ряде случаев катализатор отравляется побочными продуктами реакции. Так, в реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистой полимерной пленки (так называемого кокса), покрывающей поверхность катализатора для ее удаления цикл катализа сменяют циклом регенерации — катализатор продувают при высокой температуре воздухом для перевода кокса в С02.
Дата добавления: 2015-08-20; просмотров: 111 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Емпература зажигания — это минимальная температура, при которой технический процесс начинает идти с достаточной для практических целей скоростью. | | | ОСНОВНЫЕ СТАДИИ И КИНЕТИЧЕСКИЕ ОСОБЕННОСТИ ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИХ ПРОЦЕССОВ |