
Читайте также:
|
В связи с большим разнообразием каталитических процессов не существует единого количественного критерия активности. Это связано с тем, что применение различных катализаторов даже для одной и той же химической реакции может по-разному изменить ее механизм. Как правило, применение катализатора приводит к изменению и порядка реакции, и энергии активации, и предэкспоненциального множителя. Количественным критерием активности катализатора для данной реакции может служить, например, константа скорости, измеренная для разных катализаторов в сопоставимых условиях (стандартных). Такой подход применим, если для всех сравниваемых катализаторов данной группы остается одинаковым порядок реакции. Иногда сравнивают катализаторы по скорости реакции или по степени превращения реагентов в стандартных условиях, по количеству реагентов, вступающих во взаимодействие в единицу времени на единице поверхности катализатора (производительности, или напряженности, катализатора) и т. п.
Если каталитическая реакция имеет такой же порядок, что и не каталитическая, т. е. их константы скорости  и k — имеют одинаковые единицы измерения, то активность катализатора А можно определить, как отношение констант
и k — имеют одинаковые единицы измерения, то активность катализатора А можно определить, как отношение констант
A= 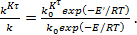 (1)
(1)
где Е| и Е — энергии активации каталитической и некаталитической реакций.
Из уравнения (1) следует, что активность тем выше, чем больше снижается энергия активации в присутствии катализатора. При этом, однако, нужно иметь в виду, что в присутствии катализатора меняется не только энергия активации, но и предэкспоненциальный множитель. Рост активности за счет снижения энергии активации сдерживается уменьшением  по сравнению c
по сравнению c  (имеет место так называемый компенсационный эффект).
(имеет место так называемый компенсационный эффект).
Температура зажигания. Наряду с активностью важной технологической характеристикой является температура зажигания катализатор 
| Т |
Дата добавления: 2015-08-20; просмотров: 71 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Атализатор не может изменить состояние химического равновесия, которое зависит от пути реакции. | | | Емпература зажигания — это минимальная температура, при которой технический процесс начинает идти с достаточной для практических целей скоростью. |