
Читайте также:
|
Катализаторы — это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.
Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации 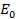 :
:
А + В 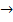 R
R
| Рис. 1. Энергетические диаграммы каталитической и некаталитической реакций: энергетический уровень: I-исходных реагентов. II — продуктов реакции; 1 — путь реакции без катализатора; 2 — путь каталитической реакции |
Ход реакции на энергетической диаграмме (рис. 1) изображен кривой I. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 2). Например, первой стадией может быть образование промежуточного активированного комплекса А 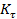 :
:
А + 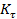 → А
→ А 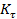
(здесь 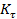 — катализатор). Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
— катализатор). Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
А 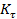 + В → R
+ В → R 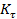
Последней стадией является разложение комплекса R 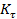 с образованием продукта R и высвобождением катализатора для нового каталитического цикла:
с образованием продукта R и высвобождением катализатора для нового каталитического цикла:
R 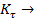 R +
R + 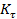
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации 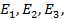 (кривая 2 на рис. 1), но как правило, высота каждого из этих потенциальных барьеров ниже энергии активации
(кривая 2 на рис. 1), но как правило, высота каждого из этих потенциальных барьеров ниже энергии активации 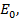 . Таким образом, в присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет проводить процесс с большей скоростью.
. Таким образом, в присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное (I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми; следовательно,
| к |
Дата добавления: 2015-08-20; просмотров: 87 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| КОНСТАНТА СКОРОСТИ ГЕТЕРОГЕННОГО ПРОЦЕССА. ЛИМИТИРУЮЩАЯ СТАДИЯ | | | Атализатор не может изменить состояние химического равновесия, которое зависит от пути реакции. |