
|
Читайте также: |
Непосредственно с кислородом галогены не соединяются. Кислородосодержащие соединения получаются косвенным путем. В основе получения кислородных соединений галогенов лежат реакции с водой и щелочами. Реакции эти для хлора, брома и иода по своему характеру очень близки между собой, но резко отличаются от подобных реакций фтора. Так при действии фтора на воду получается фтористый водород (фтородоводород), кислород, озон, пероксид водорода и в незначительном количестве F2O – фторид кислорода O+2F2–:
F2 + H2O → 2HF + O
2O → O2 3O → O3 O2 + O → O3
H2O + O → H2O2
F2 + O → OF2
O+2F2– – бесцветный газ с резким запахом, в сгущенном состоянии – это жидкость желтого цвета, tпл = -223,8º С, tкип = -144,8º С
F2O: tпл = -163º С, tкип = -57º С. Газ – слабокоричневый, жидкость – вишнево-красная, твердый – оранжевый.
F2O также можно получить при медленном пропускании F2 через 2% раствор щелочи:
2F2 + 2NaOH → 2NaF + H2O + F2O
4HI + OF2 = 2I2 + H2O + 2HF
NaOH + OF2 = NaF + H2O + O2
Известен также оксид фтора F2O2, получаемый при действии тихого электрического разряда на смесь фтора и кислорода, охлаждаемую жидким воздухом. Выше t = -95º C F2O2 распадается на F2 и O2.
По количеству оксидов различного состава хлор занимает среди галогенов первое место, за ним бром, затем фтор и иод.
Некоторым оксидам отвечают соответствующие валентному состоянию галогена кислоты и в то же время часто у галогенов имеется кислота, но нет соответствующего ей оксида:
| Валентное состояние | Фтор | Хлор | Бром | Иод | ||||
| оксид | кис-та | оксид | кис-та | оксид | кис-та | оксид | кис-та | |
| F2O | HFO | Cl2O | HOCl | Br2O | HOBr | – | HOI | |
| F2O2 | – | – | – | – | – | – | – | |
| – | – | – | HClO2 | – | – | – | – | |
| – | – | ClO2 | – | BrO2 | – | – | – | |
| – | – | – | HClО3 | – | HВrO3 | I2O2 | HIO3 | |
| – | – | Cl2O6 | – | BrO3 | – | – | – | |
| – | – | Cl2O7 | HClO4 | – | HВrO4 | – | HIO4 H5IO6 |
Из последних открытий в области неорганической химии очень интересным является получение фторноватистой кислоты (HOF), которую впервые выделили в свободном состоянии М. Стаднер и И. Эппельман в 1971 г.
Для ее получения они действовали фтором на лед при очень низкой tº.
Являясь достаточно устойчивой, она могла быть затем отделена от F2, HF и паров воды методом фракционированной конденсации. Таким образом, было получено несколько миллиграммов HOF. Конденсирующаяся при -187º С в виде белого твердого вещества, фторноватистая кислота при повышении температуры (около -117º С) превращается в бесцветную жидкость, которая кипит в пределах от -50º С до -79º С.
Для дополнительного подтверждения образования HОF было проведено масс-спектроскопическое исследование. На масс-спектрограмме отчетливо выделяется пик, отвечающий молекулярной массе 36 (HOF).
Из немногих известных реакций HOF интересно ее взаимодействие с водой, протекающее по уравнению:
HOF + H2O → HF + H2O2
При растворении хлора в воде при 0ºС выделяются желто-зеленые кристаллы состава Cl2·8H2O.
Такого же состава кристаллогидрат образует и бром при охлаждении его насыщенного раствора: Br2·8H2O.
Галогены взаимодействуют с водой по схеме: Г2 + H2O ⇄ HГ + НГО. При этом образуется хлорноватистая, бромноватистая кислоты.
При переходе от хлора к иоду данное равновесие все больше смещается влево.
Гидролиз хлора:
Cl2 + H2O ⇄ HCl + HClO
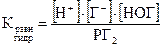
В молекулярно-ионном виде:
Cl2 + H2O ⇄ H+ + Cl– + HOCl
Константа равновесия реакции гидролиза резко уменьшается от Cl2 к I2, КpCl2 = 4·10–7, КpBr2 = 7·10–9, КpI2 = 2·10–13. Значит, измеримые количества кислоты НОГ могут быть получены гидролизом только у хлора (хлорноватистая кислота). Сместить равновесие вправо можно, связывая ионы H+ и Cl–. С этой целью можно взять оксид ртути:
HgО + 2HCl + 2HClO → HgCl2 + 2HClO + H2O
Образующийся хлорид ртути растворим, но плохо диссоциирует. Равновесие смещается в сторону образования слабых электролитов. При пропускании достаточного количества хлора во взвесь HgO получается довольно концентрированный раствор HClO.
Хлорноватистая кислота – хороший окислитель, так как она отщепляет атомарный кислород:
HClO = HCl + O
Эта реакция хорошо протекает под действием солнечного света, в присутствии катализаторов или веществ, способных легко присоединять кислород.
В ряду кислот HFO → HClO → HbrO → HIO уменьшается устойчивость, окислительная активность, кислотность.
Это очень слабые кислоты: Kд HOCl = 2·10-8, Kд HOBr = 2·10-9,
Kд HOI = 1·10-11. Кислоты эти не выделены в свободном состоянии.
При взаимодействии галогенов с растворами щелочей образуются соли кислородосодержащих кислот.
Пример:
2KOH + Cl2 = KCl + KClO + H2O
| Кислоты | Соли |
| HCl | KCl |
| хлорноватистая | гипохлориты |
| HBrO | NaBrO |
| бромноватистая | гипобромиты |
| HIO | NaIO |
| иодноватистая | гипоиодиты |
Гипохлориды натрия и калия существуют только в растворах.
Водные растворы:
KCl + KClO + H2O
Cl2 + 2KOH = KOCl + KCl + H2O (жавелевая вода)
NaCl + NaClO + H2O
Жавелевая вода применяется для отбеливания тканей, бумаги, красителей и т.д.
 При взаимодействии хлора с сухой гашеной известью образуется хлорная или белильная известь:
При взаимодействии хлора с сухой гашеной известью образуется хлорная или белильная известь:
Белильная или хлорная известь – это твердая смесь CaCl2 + Ca(OH)2 + Ca(OCl)2.
При реакции хлора со взвесью гашеной извести образуется смесь солей:
2Ca(OH)2 + 2Cl2 = Ca(OCl)2 + CaCl2 + 2H2O
хлорная известь
 Хлорная известь разлагается с выделением кислорода и хлора
Хлорная известь разлагается с выделением кислорода и хлора
CaOCl2 → CaCl2 + Cl2 + O2
Она применяется при отбеливании волокна, тканей, бумаги, для дезинфекции, в противохимической защите, для дегазации местности.
Хлорноватистая кислота слабее угольной, поэтому:
Ca(ClO)2 + H2O + CO2 = CaCO3 + 2HClO
Хлорноватистая кислота и гипохлориты являются исходными веществами для получения других кислородных соединений хлора.
Образующаяся HClO в зависимости от условий испытывает следующие превращения:
hС/λ
1) HClO → HCl + O
CaCl2
2) 2HClO = H2O + Cl2O (в присутствии водоотнимающих средств)
tº
3) 3HClO = 2HCl + HClO3 (хлорноватистая кислота).
При нагревании все кислоты НГО подвергаются реакции диспропорционирования по схеме:
3HГO = 2НГ +НГО3
HClO2 неустойчивая, окисляемость слабая, для Br, I неизвестны.
Кислоты HClO3, HBrO3 и HIO3 называются хлорноватой, бромноватой и иодноватной.
Хлорноватая кислота существует только в растворах, НГО3-кислоты сильные (сравнимы с HCl и HNO3).
В ряду HClO3, HBrO3, HIO3 увеличивается устойчивость, уменьшаются кислотные и окислительные свойства.
Иодноватная кислота существует и в растворах, и в кристаллическом виде.
Получение HIO3:
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O
Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
При осторожном выпаривании полученных растворов выделяется иодноватая кислота в виде бесцветных кристаллов. Если сильно нагреть
tº
8HClO3 → 4HClO4 + 2Cl2 + 3O2 + 2H2O
Соли кислот типа НГО3 сильные окислители, их можно получить так:
tº
6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O
конц. горячий р-р хлорат (состав головок спичек)
При охлаждении раствора бертолетова соль выпадает в осадок.
Свойства хлоратов:
Соли хлоратов:
MnO2 - катализатор
2KClO3 → 2KCl + 3O2↑
tº
4KClO3 → 3KClO4 + KCl
KClO3 + 6HCl → 3Cl2 + KCl +3H2O
3KClO3 + H2SO4 → KClO4 + 2ClO2 + K2SO4 + H2O
10KI + 2KClO3 + 6H2SO4 = 6K2SO4 + Cl2 + 5I2 + 6H2O
окислитель
2KClO3 + 8NaOH + 5MnO2 = K2MnO4 + 4Na2MnO4 + Cl2 + 4H2O
окислитель восстановитель
Соли хлораты: NaClO3, Mg(ClO3)2, Ca(ClO3)2 – являются гербицидами сплошного действия – уничтожают все растения.
При равных условиях скорость подобных реакций возрастает от хлора к иоду.
При действии раствором H2SO4 на хлораты, броматы и иодаты можно получить кислоты HClO3, HBrO3 и HIO3.
2KClO3 + H2SO4 = K2SO4 + 2HClO3
2KbrO3 + H2SO4 = K2SO4 + 2HBrO3
2HBrO3 + I2 = 2HIO3 + Br2
Только для HIO3 известен иодноватый ангидрид I2O5 – белый кристаллический порошок, получается при нагревании HIO3 до 230º С:
tº
2HIO3 → I2O5 + H2O
Выше 275º С I2O5 разлагается на I2 и O2. При самоокислении – самовосстановлении гипохлоритов на первой стадии образуется хлорит и хлорид, на второй ступени – хлорат и хлорид.
tº
NaOCl + NaOCl → NaClO2 + NaCl
хлорит
NaClO2 + NaOCl → NaClO3 + NaCl
хлорат
Хлористой и хлорноватой соответствует оксид ClO2.
Молекула ClO2 нелинейна, угол OСlO равен примерно 118º, атом хлора имеет один неспаренный электрон и несвязывающую электронную пару. ClO2 – желто-зеленый газ, неустойчив, взрывоопасен, токсичен. Получают при нагревании до 60º С слегка увлажненной смеси бертолетовой соли KClO3 и щавелевой кислоты H2C2O4.
2KClO3 + H2C2O4 = K2CO3 + CO2↑ + 2ClO2↑ + H2O
ClO2 выделяется при взаимодействии KClO3 с концентрированной H2SO4:
KClO3 + H2SO4 = KHSO4 + HClO3
3HClO3 = HClO4 + H2O + 2ClO2↑
Лучше получать ClO2 по первому пути (в атмосфере CO2 ClO2 устойчив).
ClO2 – ангидрид двух кислот:
2ClO2 + H2O = HClO2 + HClO3
хлористая хлорноватая
H2SO4
2HClO3 = H2O + 2ClO2 + O
Продукты разложения HClO3 способны воспламенять органические вещества, P, S и т.д.
Перхлораты:
4KClO3 = KCl + 3KClO4
перхлорат
При взаимодействии перхлората с H2SO4 образуется хлорная кислота:
KClO4 + H2SO = KHSO4 + HClO4
В чистом виде HClO4 представляет собой бесцветную маслянистую жидкость, замерзающую при t = -112º C, tкип = 39º С.
Кислота HClO4 устойчива в водных растворах, безводная иногда взрывает. Это самая сильная кислота.
2HClO4 + P2O5 = 2HPO3 + Cl2O7
метафосфорная
Это одноосновная кислота, сильный окислитель, окисляет дерево, бумагу. На коже дает сильные, долго незаживающие раны. Однако она менее сильный окислитель, чем хлорноватая кислота, так как более устойчива.
Cl2O7 – маслянистая бесцветная, взрывоопасная жидкость, tкип = 82º С, tпл = -91º С, получают обезвоживанием кислоты: 4HClO4 + P4O10 = 2Cl2O7 + 4HPO3.
Для брома соединений со степенью окисления +7 до 1968 г. не было известно. В 1968 г. окислением бромата: KbrO3 + XeF2 + H2O → KBr+7O4 + Xe + 2HF. Также получена и HBrO4 – безводная бромная кислота не может быть синтезирована.
Существует иодная кислота HIO4. Получение:
2HClO4 + I2 = 2HIO4 + Cl2
При выпаривании раствора образуются бесцветные кристаллы HIO4·2H2O с tпл = 130º С. В сильно кислых растворах она существует в виде слабой кислоты состава H5IO6. Существуют средние соли этой кислоты Ag5IO6, Ba5(IO6)2. При нагревании HIO4 образуется I2O5 и О2: 2HIO4 → I2O5 + O2 + H2O.
Опыты:
1. Взрыв смеси KClO3 и S в ступке при растирании.
2. Взрыв смеси KClO3 и P при ударе.
Выводы: Для хлора известны следующие кислородные кислоты: HCl+O (хлорноватистая), HCl3+O2 (хлористая), HCl5+O3 (хлорноватая), HCl7+O4 (хлорная). С увеличением степени окисления атома хлора возрастает устойчивость, сила кислоты, уменьшаются окислительные свойства.
Кислородным кислотам хлора соответствуют следующие соли:
| Кислоты | Соли |
| хлорноватая HClO хлористая HClO2 хлорноватая HClO3 хлорная HClO4 | гипохлориты хлориты хлораты перхлораты |
В ряду кислот HClO, HBrO, HIO ослабевают устойчивость, окислительные и кислотные свойства. Для кислот  , HВrO3,
, HВrO3,  увеличивается устойчивость и уменьшаются окислительные и кислотные свойства.
увеличивается устойчивость и уменьшаются окислительные и кислотные свойства.
Практическое значение фтора и его соединений:
Роль фтора и его соединений в производстве ядерного горючего исключительна. Можно утверждать, что не будь фтора, в мире до сих пор не было бы ни одной атомной электростанции. Гексафторид урана UF6 используется для разделения 235U и 238U, которые закипают при t = 3500º C, а UF6 кипит при 56,2º С. После разделения UF6 → UF4 → U.
Очень ценны фторорганические соединения: фторопласт-4, фторопласт-3 – легки, инертны, не горючи.
Соединения фтора с углеродом – фреоны, хладореагенты. В домашних холодильниках:
| tпл, Сº | tкип, Сº | |
| CF2Cl2 | -155 | -29,8 |
| CF3Cl | -180 | -81,5 |
| CF4 | -188 | -128 |
| CHF2Cl | -160 | -40,8 |
| C2F3Cl3 | -35 | 47,5 |
CF2Cl2 – дифтордихлорметан, бесцветный нерастворимый в воде газ, негорючий, запах похож на запах эфира.
Фреоны не горят даже в атмосфере чистого кислорода, их используют как пламегасители.
HF – для травления стекла, в производстве беззольных фильтров, в качестве дезинфектора для предупреждения заболевания дрожжей в бродильной промышленности.
Значение галогенов в природе, в сельском хозяйстве и в жизни человека:
Живая клетка за редчайшими исключениями не содержит галогеносодержащие биомолекулы. Напротив, галогеносодержащие органические вещества очень токсичны и применяются в качестве пестицидов (гербицидов, инсектицидов, фунгицидов). Искусственное введение данных элементов в виде их соединений может вызвать смерть живых клеток в организме. И тем не менее, хлор, а тем более фтор и иод относятся к необходимым микроэлементам. Растения усваивают хлор из почвенных растворов в виде гидратированного хлорид-иона. Физиологическая норма содержания Cl– в клеточном растворе и межклеточных жидкостях зависит от природы растительных и животных организмов и особенностей их органов. У человека содержание хлора составляет 0,15%.
Хлорид-ионы – главные отрицательно заряженные ионы внутриклеточного раствора и межклеточных жидкостей, они образуют тонкие ионные слои по обеим сторонам клеточных мембран и участвуют, таким образом, в создании электрического мембранного потенциала, который регулирует процессы переноса неорганических и органических веществ сквозь мембраны. Гидратированные хлорид-ионы участвуют в поддержании физиологически требуемой наполненности клетки водой.
Хлороводородная кислота – составная часть желудочного сока животных, она необходима для нормального пищеварения.
При недостатке фтора развивается анемия. Он содержится в эмали зубов и костных тканях. При содержании фтора в питьевой воде менее 1 мг/л у большинства людей развивается кариес зубов. При концентрациях больших, чем 8 мг/л нарушаются процессы обновления костных тканей и развивается опасное заболевание фтороз – поражение щитовидной железы, почек и других органов.
Соединения брома используют в качестве лекарств при расстройствах центральной нервной системы.
Иод участвует в гормональной активности щитовидной железы: входит в состав тирозина – главного ее гормона. Недостаток иода в питьевой воде и пище приводит к заболеванию эндемическим зобом. Водные (KI3) и спиртовые растворы иода применяют как антисептические средства.
Дата добавления: 2015-07-21; просмотров: 869 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства НГ | | | Галогены в природе |