
Читайте также:
|
Газообразный, жидкий и твердый фтороводород ассоциирован за счет образования водородных связей.
Энергия водородных связей в HF выше, чем в H2O и NH3 и составляет 40 кДж/моль. Из-за образования водородных связей HF имеет высокие tкип = +20º С, tпл = –83º С. Безводный жидкий фтороводород – сильно ионизирующий растворитель, в нем растворимы многие электролиты.
| HF | HCl | HBr | HI | |
| tпл, ºС | -83 | -112 | -88 | -51 |
| tкип, ºС | +20 | -84 | -67 | -35 |
Аномалия свойств фтороводорода в ряду галогеноводородов объясняется ассоциацией молекул за счет водородных связей. Состав молекул газообразного фтороводорода выражается формулой (HF)n. Среднее значение n = 4. При нагревании происходит распад ассоциатов и при 90ºС n достигает единицы.
В жидком состоянии фтороводород бесцветен, очень хорошо растворим в воде: ниже 20º С смешивается с ней в любых соотношениях,  = 1,91 Д,
= 1,91 Д, 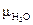 = 1,91 Д. Дипольные моменты очень близки друг другу. В одном объеме воды при 0º С растворяется около 500 объемов хлороводорода, а при 20º С – 450 объем HCl.
= 1,91 Д. Дипольные моменты очень близки друг другу. В одном объеме воды при 0º С растворяется около 500 объемов хлороводорода, а при 20º С – 450 объем HCl.
Растворимость HBr и HI в воде несколько выше, чем хлористого водорода.
Безводные галогеноводороды обладают низкой электропроводностью, электропроводность безводного HF очень низка и вызвана диссоциацией:
3HF = H2F+ + HF2–
Электропроводность других безводных галогеноводородов еще ниже и указывает на значительное ослабление процесса диссоциации.
В водных растворах галогеноводороды, за исключением HF, хорошо проводят электрический ток, являясь сильными электролитами.
Раствор HF проводит плохо электрический ток, так как благодаря системе водородных связей молекулы HF объединяются в устойчивые агрегаты.
Фтористоводородная (фтороводородная) кислота лишь на порядок сильнее уксусной:
HF + H2O = H3O+ + F– Кд = 7·10-4
Остальные галогеноводороды в водных растворах сильные кислоты и почти нацело диссоциируют на ионы. Их сила возрастает в направлении HCl → HBr → HI, причем силы HBr и HI близки.
Чтобы не быть бездоказательными, мы должны знать какими факторами определяется сила галогеноводородных кислот.
Можно предположить, что сила кислот связана с энтальпией образования галогеноводородов из простых веществ или же с энтальпией связей:
| НГ | ΔHº298 образования | ΔHº связи | ||
| кал/моль | кДж/моль | кал/моль | кДж/моль | |
| HF (газ) | -64 000 | -267.52 | 134 320 | 561.46 |
| HCl (газ) | -22 240 | -92.96 | 102 200 | 427.20 |
| HBr (газ) | -8 600 | -35.95 | 86 090 | 359.86 |
| HI (газ) | -3 000 | -12.54 | 70 410 | 294.31 |
Из этих данных видно, что энтальпии образования галогеноводородов изменяются параллельно силе их кислот. Наименьшая энтальпия у HF, несомненно, характеризует HF как слабую кислоту. Различие в ΔHºобр между соседними галогеноводородами отвечает различию их как кислот. По энтальпиям связи галогеноводороды располагаются в том же направлении. Однако эти данные не дают правильного представления о силе галогеноводородных кислот.
Сравним энтальпии следующих кислот: HF, HCl, HBr, HI – они примерно одинаковы, за исключением HF, имеющей аномально малое значение ΔHº298 дисс.
| НГ | ΔHº298 дисс. | ΔSº298 дисс. | TΔSº | ΔGº298 дисс. | |||
| кал/моль | кДж/моль | Дж/моль·град | кал/моль | кДж/моль | кал/моль | кДж/моль | |
| HF | -1000 | -4.18 | -87.78 | -6300 | -26.4 | -5300 | -22.15 |
| HCl | -10000 | -41.8 | -54.34 | -3900 | -16.3 | -6100 | -25.50 |
| HBr | -11000 | 45.98 | -41.8 | -3000 | -12.5 | -8000 | -33.44 |
| HI | -9000 | -37.62 | -12,54 | -900 | -3.76 | -8100 | -33.86 |
У фтороводородной кислоты наибольшая отрицательная величина энтропии диссоциации (ΔSº) из-за очень высокого стремления малого по размеру иона фтора быть окруженным гидратной оболочкой. Численные значения энтропий диссоциации падают по мере перехода к HI, у ионов I– стремление к гидратации сильно ослаблено. Изменение изобарного потенциала при диссоциации только у HF положительно. HF – слабая кислота, у всех остальных кислот ΔGº отрицательно и численно возрастает к HI – самой сильной в этом ряду кислоте.
Возрастание силы кислот в ряду: HI → HCl → HBr → HI объясняется уменьшением электроотрицательности галогенов, а в связи с этим и уменьшением прочности связи Н–Э в молекулах галогеноводородов от фтора к астату.
Сила галогеноводородных кислот увеличивается от HF к HI:
| HF | HCl | HBr | HI | |

| ||||
| Для 0,1 н раст-в α | 8% | 92,6% | 93,5% | 95% |
Увеличивается поляризуемость молекул под действием воды. Соляная, хлористоводородная, бромисто-иодистоводородная кислоты обладают общими свойствами сильных кислот.
Молекулы наиболее слабой фтороводородной кислоты склонны к ассоциации, поэтому для нее известны кислые соли.
Дата добавления: 2015-07-21; просмотров: 244 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Галогеноводороды НГ | | | Химические свойства НГ |