
|
Читайте также: |
HNO3 + 3HCl = Cl2 + Cl + NO + 2H2O
Au + 3Cl = AuCl3
Прямой синтез: H2 + Г2 = 2НГ + Q F2 + H2 = 2HF
QHF = 268 кДж/моль
QHCl = 92,2 кДж/моль
QHBr = 35,5 кДж/моль
QHI = –25,14 кДж/моль
Cl2 + H2 = 2HCl
Cl2 + hν → Cl* + Cl
Cl* + H2 = HCl + H*
H* + Cl2 = HCl + Cl*
CaF2 + H2SO4 = CaSO4 + 2HF
NaCl + H2SO4 = NaHSO4 + HCl
NaCl + NaHSO4 = Na2SO4 + HCl
NaBr + H2SO = NaHSO4 + HBr
2HBr + H2SO4 = 2H2O + SO2 + Br2
H2SO4 + 6HI = 4H2O + S + 3I2
H2SO4 + 8HI = 4H2O + H2S + 4I2
NaI + H2SO4 = NaHSO4 + HI
2Cl2 + 2H2O + C = CO2 + 4HCl
2Br2 + 2H2O + C = CO2 + 4HBr
РГ3 + 3Н2О = Н3РО3 + 3НГ
РCl5 + 4H2O = H3PO4 + 5HCl
H2S + I2 = 2HI + S↓
Энергия водородных связей в HF = 40 кДж/моль.
| HF | HCl | HBr | HI | |
| tпл, ºС | -83 | -112 | -88 | -51 |
| tкип, ºС | +20 | -84 | -67 | -35 |
 = 1,91 Д,
= 1,91 Д, 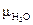 = 1,91 Д. 3HF = H2F+ + HF2–
= 1,91 Д. 3HF = H2F+ + HF2–
HF + H2O = H3O+ + F– Кд = 7·10-4
| НГ | ΔHº298 образования | ΔHº связи | ||
| кал/моль | кДж/моль | кал/моль | кДж/моль | |
| HF (газ) | -64 000 | -267.5 | 134 320 | 561.46 |
| HCl (газ) | -22 240 | -92.96 | 102 200 | 427.20 |
| HBr (газ) | -8 600 | -35.95 | 86 090 | 359.86 |
| HI (газ) | -3 000 | -12.54 | 70 410 | 294.31 |
| НГ | ΔHº298 дисс. | ΔSº298 дисс. | TΔSº | ΔGº298 дисс. | ||||
| кал/моль | кДж/моль | ДЖ/моль·К | кал/моль | кДж/моль | кал/моль | кДж/моль | ||
| HF | -1000 | -4.18 | -87.78 | -6300 | -26.34 | -5300 | -22.15 | |
| HCl | -10000 | -41.80 | -54.34 | -3900 | -16.30 | -6100 | -25.50 | |
| HBr | -11000 | -45.98 | -41.8 | -3000 | -12.54 | -8000 | -33.6 | |
| HI | -9000 | -37.62 | -12.54 | -900 | -3.76 | -8100 | -33.86 | |
| HF | HCl | HBr | HI | |

| ||||
| Для 0,1 Н раствора | 8% | 92,6% | 93,5% | 95% |
Ag2O + 2HF = 2AgF + H2O
SiO2 (кр.) + 4HF (ж) =SiF4 (г) + 2H2O (ж)
SiO2 + 6HF = H2SiF6 + 2H2O
HF = H+ + F– K = 7,2·10-4
F– + HF = HF2– K = 5,1
KF·HF, KF·2HF, KF·3HF.
AgCl, PbCl2, PbBr2 – белого цвета, AgI, PbI2 – желтого цвета, AgBr – желтоватого цвета.
I– + I2 = I3–, пример – KI3
KCl + H2SO4 = KHSO4 + HCl↑
Дата добавления: 2015-07-21; просмотров: 66 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства | | | Кислородные соединения галогенов |