
Читайте также:
|
Основания – сложные вещества, состоящие из атомов металла (или аммонийной группы NH4), соединенных с одной или несколькими гидроксильными группами ОН.
С точки зрения электролитической диссоциации, основания – это электролиты, диссоциирующие в водном растворе или расплаве с образованием отрицательных ионов одного типа – ОН-.
КОН = К+ + ОН-,
Основания характеризуются кислотностью, которая определяется числом групп ОН, участвующих в химических реакциях. По кислотности основания делят на однокислотные (КОН, LiOH, NH4OH) и многокислотные
(Са(ОН)2, Fe(OH)2). Однокислотные основания диссоциируют в одну ступень, двух- и более кислотные основания диссоциируют ступенчато.
Са(OH)2 = СаOH+ + OH-
СаOH+ = Са2+ + OH-
В принципе, любое многокислотное основание в химической реакции, может выступать как однокислотное:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O.
Названия оснований образуются с помощью слова гидроксид и названия металла в родительном падеже: NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция. Если металл проявляет в своих соединениях переменную степень окисления, то в конце названия по системе Штока ставится степень окисления (валентность). Например, Fe(OH)3 гидроксид железа (III).
По растворимости в воде основания делят на растворимые в воде основания – щелочи (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Cа(OH)2, Sr(OH)2, Ra(OH)2) и труднорастворимые в воде (все остальные)
Физические свойства. Все основания при обычных условиях твердые вещества (кроме гидроксида аммония, который существует только в водном растворе), имеют разную окраску. Основания щелочных и щелочно-земельных металлов растворимы в воде (щелочи), остальные труднорастворимы в воде. Растворы щелочей мылкие на ощупь.
Графические формулы оснований:
Na – O – H
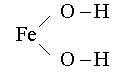
Дата добавления: 2015-07-25; просмотров: 64 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Получение кислот. | | | Химические свойства. |