
Читайте также:
|
1. Кислые соли взаимодействуют с основаниями и превращаются в средние соли:
NaHSO4 + NaOH = Na2SO4 + H2O,
Ca(H2PO4)2 + 2Ca(OH)2 = Ca3(PO4)2 + 4H2O,
2NaHCO 3 + Ba(OH) 2 = BaCO 3 + Na2CO 3 + 2H2O.
2. Кислые соли взаимодействуют с кислотами если:
а) образуется более летучая или слабая кислота:
NaHCO 3 + HCl = NaCl + CO2 ↑ + H 2O
б) образуется более кислая соль:
Na2HPO4 + H3PO 4 = 2NaH2PO4.
3. Кислые соли вступают в реакции обмена с другими солями, если выполняется одно из условий реакций обмена:
Ba(HCO)3 + Na2SO4 = BaSO4 + 2NaHCO3
Основные соли – это продукты неполного замещения гидроксогрупп в молекуле многокислотного основания на кислотный остаток. Основные соли образуются при избытке основания.
Названия основных солей образуются путем прибавления к названию соответствующей средней соли приставки гидроксо:
Ca(OH)2 + HCl = CaOHCl + H2O
хлорид гидроксокальция
2Сr(OH)3 + H2SO4 = (Cr(OH)2)2SO4 + 2H2O
сульфат дигидроксохрома (III) или
тетрагидроксосульфат (VI) дигидроксохрома (lll)
Сr(OH)3 + H2SO4 = CrOHSO4 +2H2O
сульфат гидроксохрома (III) или
тетраоксосульфат(VI) гидроксохрома (III)
С точки зрения электролитической диссоциации, основные соли – это электролиты, которые диссоциируют на сложный катион и анион кислотного остатка. При дальнейшей диссоциации сложного катиона образуются гидроксид – ионы ОН-.
CaOHCl = CaOH+ + Cl-(по типу сильного электролита)
CaOH+ = Ca2+ + OH-(по типу слабого электролита)
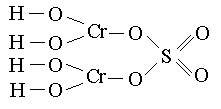
Графические формулы основных солей:
(Cr(OH)2)2SO4 CuOHNO3
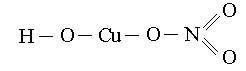
Дата добавления: 2015-07-25; просмотров: 125 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства. | | | Химические свойства. |