
Читайте также:
|
Распределение электронной плотности в молекулах однозамещенных производных бензола до начала реакции замещения объясняет характер ориентирующего влияния заместителей в статическом состоянии (статические факторы).
Однако в момент реакции электрофильного замещения под влиянием атакующей частицы происходит значительное перераспределение электронной плотности, которое часто оказывает решающее влияние на скорость и направление реакции.
Причем динамические факторы, как правило, имеют более существенное значение, чем статические
В тех случаях, когда статические факторы способствуют иной ориентации, чем динамические, определяющая роль принадлежит факторам динамическим.
Такое «несогласованное действие» статических и динамических факторов наблюдается при наличии в качестве заместителей ароматического ядра, например, галогенов.
Главной стадией, определяющей направление и скорость реакций электрофильного замещения является стадия образования сигма-комплекса.
Для объяснения влияния различных заместителей на скорость и направление реакций электрофильного замещения в монозамещенных бензолах необходимо учитывать энергетическую выгодность образования того или иного ơ-комплекса, т.е. механизм реакции.
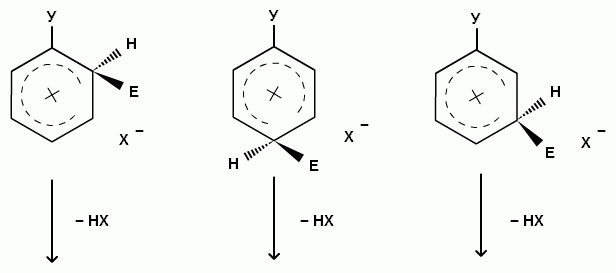
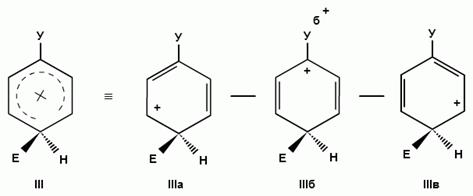
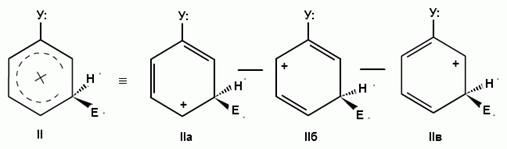
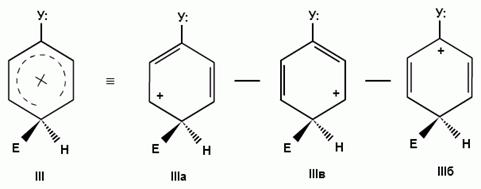
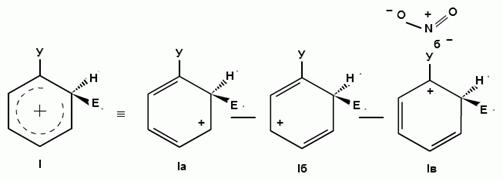
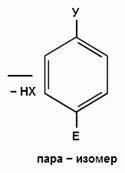
При взаимодействии монозамещенных бензолов с электрофильным реагентом возможно, хотя и с различной степенью вероятности, образование трех изомерных продуктов: орто-, мета-, пара-изомеров:
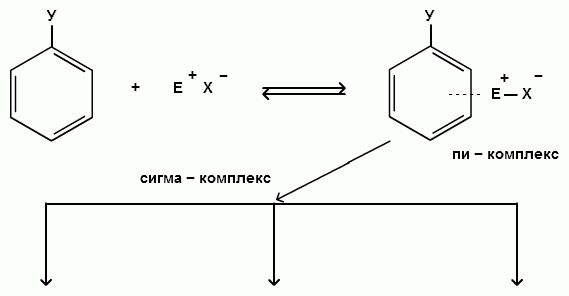
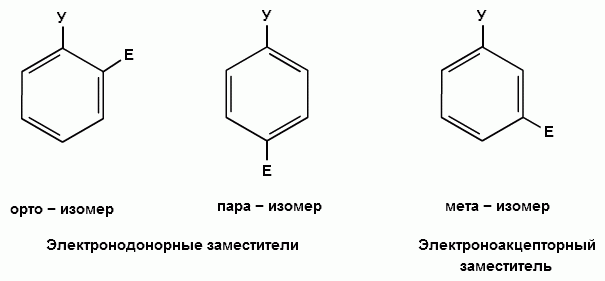
Электронодонорные заместители, повышающие электронную плотность бензольного кольца, особенно орто- и пара-положений, облегчают образование π-комплекса и способствуют стабилизации ơ-комплексов в орто- и пара-положениях, что приводит к образованию орто- и пара-изомеров.
Электроноакцепторные заместители, понижающие электронную плотность бензольного кольца, особенно орто- и пара-положений, сильно затрудняют образование π-комплекса и стабилизируют ơ-комплекс в мета-положении, что приводит к образованию мета-изомера.
Это можно наглядно показать при использовании резонансных граничных структур.
При этом следует учитывать следующие правила:
1) из всех возможных резонансных граничных структур более энергетически выгодны те, в которых за счет заместителя У возникает дополнительная возможность делокализации положительного заряда, привнесенного электрофильной частицей Е+;
2) чем больше можно написать резонансных граничных структур, тем более стабилен будет соответствующий сопряженный карбкатион (ơ-комплекс).



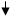
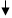
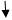
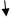

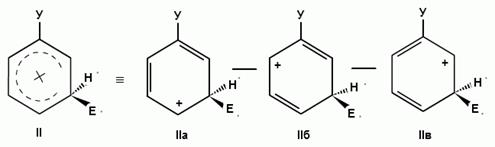



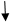
Ϭ-комплексы Резонансные граничные структуры
Рис. 1. Заместители первого рода:
1 тип: +I, М=0 (−СН3, −СН2R, −CHR2, −CR3)









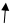
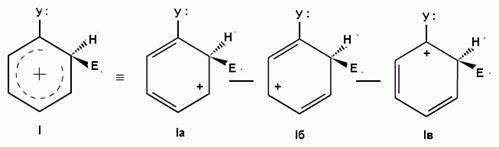




















Ϭ-комплексы Резонансные граничные структуры
Рис. 2. Заместители первого рода
2 тип: +М; -I (+M > -I)
3 тип: +M; -I (+M < -I)
3 тип: Исключение составляют галогены:
являются дезактивирующими (- I –эффект - скорость),
но ориентируют в орто- и пара-положения (+М-эффект - ориентация)


















Ϭ-комплексы Резонансные граничные структуры
Рис.3. Заместители второго рода
1 тип: -I, M = 0
2 тип: -I, -М
3 тип: -I M=0 (заместители смешанного действия)
Дополнительный материал
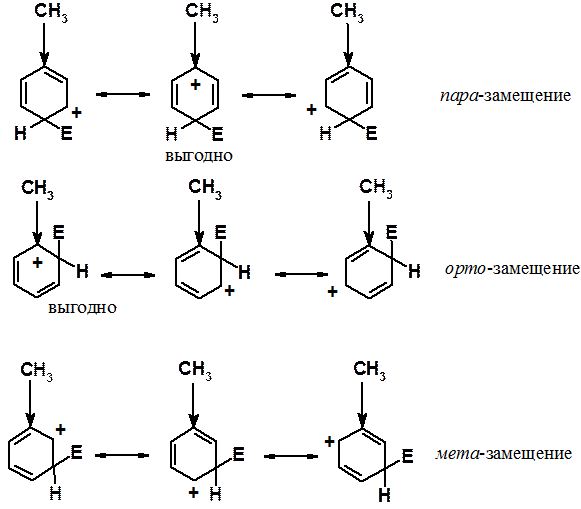
Один из самых простых примеров – свойства алкильных групп, обладающих положительным индуктивным (+I) эффектом. Индуктивный эффект проявляется тем сильнее, чем меньше расстояние. При замещении в орто - или пара -положения среди соответствующих граничных структур есть по одной особенно энергетически выгодной. В них донорная группировка непосредственно связана с углеродом, несущим положительный заряд. В случае замещения в мета -положение такой энергетически выгодной структуры нет. Группировки, обладающие +I эффектом, - орто - и пара -ориентанты.
Рассмотрим свойства группировок, обладающих +М эффектом (способных отдавать электронную плотность за счет эффекта сопряжения) на примере амино-группы.
При атаке в орто - и пара -положения соответствующие s-комплексы могут быть изображены с помощью четырех граничных структур. Одна из них энергетически очень выгодна, поскольку она представляет собой не карбониевый, а аммониевый катион. При реакции в мета -положение структуру такого типа написать не удается. Аммониевые катионы очень устойчивы, достаточно вспомнить о существовании большого числа неорганических солей (например, NH4Cl), стабильных при комнатной температуре. Кроме того, при оценке стабильности ионов (молекул и свободных радикалов) с использованием граничных структур применяется простое правило: чем больше граничных структур можно написать, тем стабильнее ион (молекула, свободный радикал). Отчетливо видно, что при вхождении электрофила в орто - и пара -положения соответствующие s-комплексы показаны с помощью четырех структур, а при реакции в мета -положение граничных структур только три.
Таким образом, донорные заместители активируют все положения кольца к реакции ароматического электрофильного замещения, но орто - и пара -положения активированы в большей степени, чем мета -.
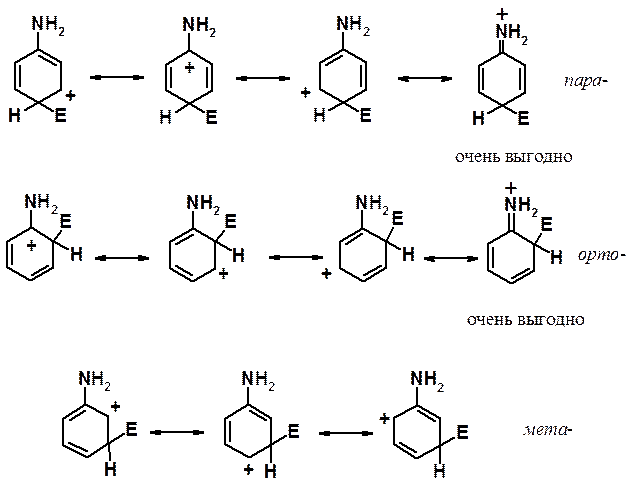
Акцепторные заместители (дезактивирующие) направляют входящий заместитель в мета -положение кольца. Доказательство аналогично изложенному выше. При протекании реакции в орто - или пара -положения есть по одной очень богатой энергией граничной структуре. В них акцептор непосредственно связан с атомом углерода, несущим положительный заряд. Как было указано, индуктивный эффект проявляется на небольших расстояниях. В этих граничных структурах акцептор сильнее всего уменьшает электронную плотность на атоме углерода, т.е. еще больше увеличивает на нем положительный заряд. Энергия орто - и пара -s-комплексов выше, чем у интермедиата реакции, протекающей в мета -положение. В последнем случае нет особенно невыгодных по энергии структур.
Акцепторные (дезактивирующие) заместители дезактивируют все положения бензольного цикла в реакциях ароматического электрофильного замещения, но мета -положение дезактивировано в меньшей степени, чем орто - и пара -. Следовательно, акцепторы являются мета -ориентантами.
В некоторых изданиях орто -, пара -ориентанты называют ориентантами I рода, мета -ориентанты – ориентантами II рода.
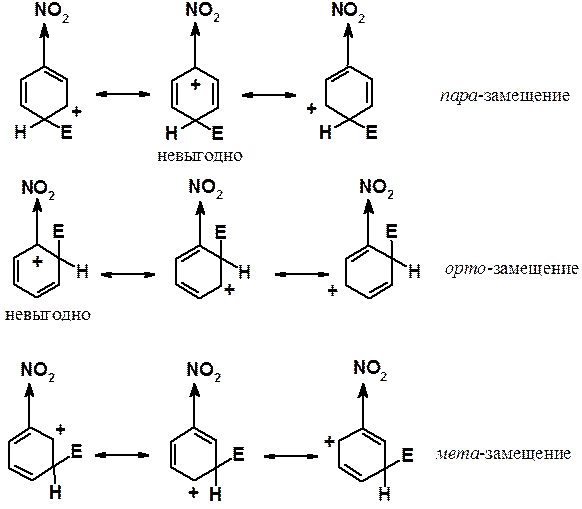
Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в мета- положения, называются ориентантами второго рода.
К ним относятся:
-CHHal2, -СHal3, -NR3(+), -C(O)H, -C(O)R, -CN, -SO3H, C(O)OH, -C(O)OR, NO2
(Hal - галоген = F, Cl, Br, I).
Важно заметить, что просто галогены относятся к ориорто-пара-ориентантам, потому что они хотя и дезактивируют ядро, но из-за мезомерного эффекта, все же напраляют замещение в орто- и пара положение.
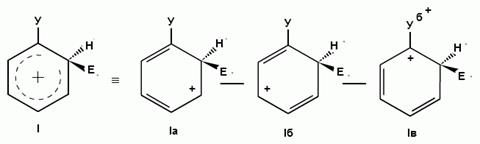
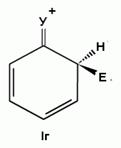
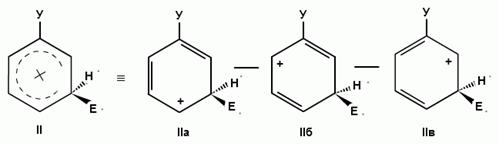
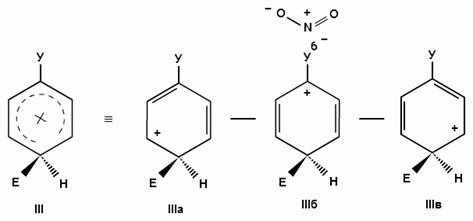
Для объяснения ориентации замещения рассмотрим строение сигма-комплексов при атаке в орто-, мета- и пара-положения монозамещенного бензола (как уже отмечалось, образование сигма-комплексов обычно является скоростьопределяющей стадией электрофильного замещения; cледовательно, легкость их образования должна определять легкость протекания замещения в данное положение):
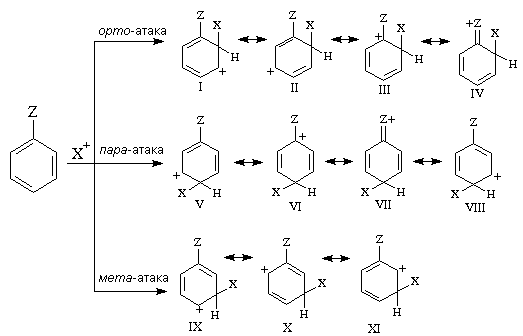
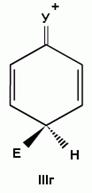
Если группа Z - донор электронов (неважно, индуктивный или мезомерный), то при орто- или пара-атаке она может принимать непосредственное участие в делокализации положительного заряда в сигма-комплексе (структуры III, IV, VI, VII). Если же Z - акцептор электронов, то указанные структуры будут энергетически невыгодными (из-за наличия частичного положительного заряда на атоме углерода, связанном с электроноакцепторным заместителем) и в этом случае оказывается предпочтительной мета-атака, при которой не возникает таких структур.
Приведенное выше объяснение дано на основании так называемого динамического эффекта, т. е. распределения электронной плотности в реагирующей молекуле. Ориентацию электрофильного замещения в монозамещенных бензолах можно объяснить и с позиции статических электронных эффектов - распределения электронной плотности в нереагирующей молекуле. При рассмотрении смещения электронной плотности по кратным связям можно заметить, что при наличии электронодонорного заместителя более всего повышена электронная плотность в орто- и пара- положениях, а при наличии электроноакцепторного заместителя эти положения наиболее обеднены электронами:
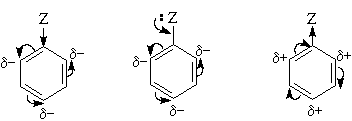
Особый случай представляют собой галогены - будучи заместителями в бензольном ядре, они дезактивируют его в реакциях электрофильного замещения, однако являются орто-, пара-ориентантами. Дезактивация (снижение скорости реакции с электрофилами) связана с тем, что, в отличие других группировок с неподеленными электронными парами (таких как -OH, -NH2 и т. п.), обладающих положительным мезомерным (+М) и отрицательным индуктивным эффектом (-I), для галогенов характерно преобладание индуктивного эффекта над мезомерным (+М< -I).
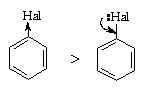
В то же время, атомы галогенов являются орто, пара-ориентантами, поскольку способны за счет положительного мезомерного эффекта участвовать в делокализации положительного заряда в сигма--комплексе, образующемся при орто- или пара- атаке (структуры IV, VII в приведенной выше схеме), и тем самым снижают энергию его образования.
Дата добавления: 2015-07-12; просмотров: 437 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Мезомерные эффекты. | | | Понятие ароматичности. |