
Читайте также:
|
Многие реагенты, способные присоединяться по двойной связи, способны вступать и в реакции электрофильного замещения в ароматическом ядре:
Общая схема:
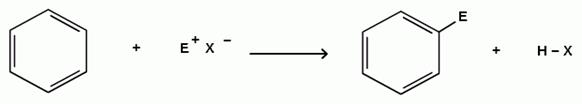
Е+Х- = Cl2, Br2, HNO3, H2SO4, HOCl, HOBr, RCl
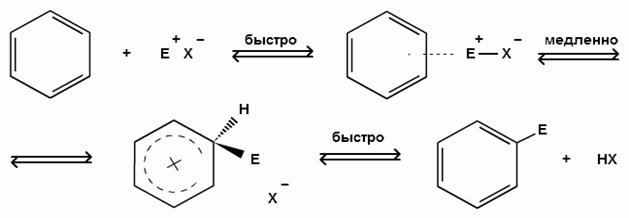
Механизм SEаром
Между механизмом реакций электрофильного замещения (SEаром) в ароматическом ядре и механизмом электрофильного присоединения (АЕ) к алкенам имеется определенное сходство. В обоих случаях процесс имеет ионный характер и является трехстадийным. Как у алкенов, так и у ароматического кольца имеются подвижные π-электроны, которые способны активно взаимодействовать с электрофильным реагентом.
1) Первой стадией электрофильного замещения является образование π-комплекса в результате взаимодействия π-электронной системы бензольного кольца с электрофильным реагентом; при этом атакующая электрофильная частица связывается со всеми шестью π-электронами кольца:
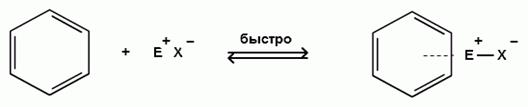
π-комплекс
Для алкенов первой стадией электрофильного присоединения является также образование π-комплекса:
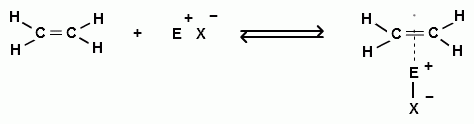
π-комплекс
2) Второй стадией, определяющей скорость реакции, является переход π-комплекса в σ-комплекс (комплекс Уэланда).
Это происходит в результате выделения из системы шести π-электронов двух электронов для образования новой σ-связи с электрофильным реагентом. Оставшиеся четыре π-электрона распределяются между пятью углеродными атомами бензольного кольца:
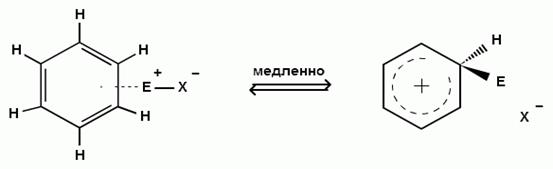
π – комплекс cигма –комплекс (комплекс Уэланда)
σ-Комплекс является сопряженным карбокатионом, где положительный заряд делокализован в системе пяти углеродных атомов, находящихся в состоянии sp2-гибридизации. Шестой углеродный атом при образовании σ-комплекса переходит из состояния sp2-гибридизации в состояниеsp3-гибридизации, приобретая при этом тетраэдрическую конфигурацию и в сопряженной системе не участвует.
Распределение электронной плотности в сопряженном карбокатионе (σ-комплексе), можно представить в виде трех граничных структур:
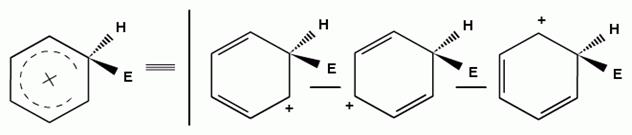
Для алкенов второй стадией электрофильного присоединения является также образование карбокатоина:
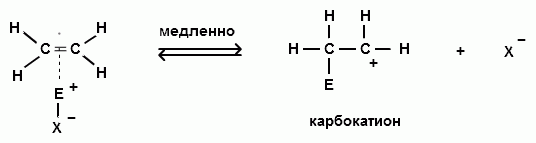
3) Третья стадия реакций электрофильного замещения в ароматическом ядре отличается от третьей стадии реакций электрофильного присоединения к алкенам.
В реакциях электрофильного замещения в ароматическом ядре промежуточное соединение - σ-комплекс представляет собой неустойчивый карбокатион, лишенный ароматичности, так как его образование связано с разрушением стабильной 6π-электронной системы бензола. Поэтому σ-комплекс легко превращается опять в стабильную систему бензола путем отщепления Е+ или Н+. В большинстве случаев легче происходит отщепление протона и образуется замещенный бензол. При этом углерод из состояния sp3- гибридизации переходит в состояние sp2-гибридизации:
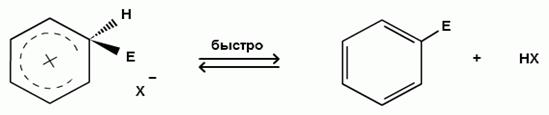
Ϭ - комплекс
При этом выигрывается разница в энергии резонанса в ароматическом кольце (150,7 кДж/моль), в σ-комплексе (108,7 кДж/моль)
В случае же электрофильного присоединения к алкенам потеря протона не приведет к значительному выигрышу энергии и образующийся промежуточный карбокатоин быстро взаимодействует с анионом, давая устойчивый продукт присоединения:
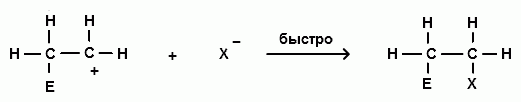
Именно, в быстром отщеплении протона и заключается отличие процесса электрофильного замещения в ароматическом ряду от электрофильного присоединения к алкенам.
Таким образом, весь процесс электрофильного замещения в ароматическом ряду можно изобразить одной схемой:
Дата добавления: 2015-07-12; просмотров: 139 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Массаж спины | | | Классификация и электронные эффекты заместителей. |