
Читайте также:
|
Розчини хімічного міднення можуть бути концентровані (швидкої дії) і неконцентровані (повільної дії). Концентрація солей двухвалентной міді, що входять до складу розчину, забезпечує потрібну швидкість міднення.
Основним відновником є формальдегід, який відновлює мідь на холоду. Як показують дослідження, швидкість відновлення міді збільшується зі збільшенням концентрації формальдегіду, причому збільшення більш значно при невеликих концентраціях СН 3 О. Крім того, чим вище в розчині концентрація іонів міді, тим сильніше вплив концентрації формальдегіду на швидкість процесу міднення. В якості відновників можна застосовувати гіпофосфіт і гідразин, але вони менш зручні, тому що їх відновлювальні властивості виявляються лише при підвищеній температурі.
Важливо враховувати рН розчину Розчини, в яких Сі (II) відновлюється гіпофосфіти або гідросульфітом, є зазвичай кислими. Гідразин і формальдегід відновлюють мідь в лужному середовищі. Відновлювальний здатність формальдегіду збільшується з підвищенням лужності середовища. Відновлення Сu (II) формальдегідом починається лише при рН> 11 і швидкість відновлення збільшується з підвищенням рН (рис. 11). Величина рН неконцентровані розчинів міднення зазвичай не нижче 12.0, а концентрованих - може бути 11.5.

Рис. 11. Залежність швидкості утворення мідного шару від рН розчину: 1 - у присутності солі нікелю, 2 - без солі нікелю.
Для розчинення солей міді в лужному розчині в ньому мають бути присутні ліганди, які зв'язують іони міді в комплекс. З іонами міді утворюють комплекси іони гідроксилу тартрату, оксалату карбонату, аміак, гліцерин, трилон Б і деякі ін комплексообразователи (ліганди) не тільки збільшують розчинність солей міді в лужному середовищі але і впливають на процес відновлення іонів міді. Отже, речовини утворюють міцні комплекси з іонами міді збільшують стійкість розчинів хімічного міднення. Крім того, комплексообразователи впливають на швидкість каталітичного відновлення міді і на фізичні властивості одержуваного покриття щільність, блиск, колір і т.п. В якості комплексоутворювачів та блескобразующіх речовин можуть бути використані також амінооцтовою кислоти, етіленаміноуксусние кислоти. Найпоширеніші комплексообразователи - тартрату (сегнетова сіль) і гліцерин.
Для полегшення утворення покриття і поліпшення зчеплення в розчин міднення рекомендується вводити різні поверхнево-активні речовини (змочувачі), типу препарату «Прогрес», зменшують поверхневий натяг і полегшують виділення водню у вигляді малих бульбашок.
На підставі промислового досвіду застосування розчинів хімічного міднення при металізації діелектриків і у виробництві друкованих плат рекомендуються розчини, склади яких представлені в табл. 8.
Таблиця 8
Розчини хімічного міднення
| Компоненти | Концентрація компонентів розчину | ||
| Мідь сірчанокисла (кристалогідрат) | .10-15 | 25-35 | 25-35 |
| Сегнетова сіль | 50-60 | 150-170 | |
| Гідроксид натрію | .10-15 | 40-50 | 30-40 |
| Натрій вуглекислий | .2-3 | 25-35 | 20-30 |
| Трилон Б | 80-90 | ||
| Фомалін (40%-ний), мл / л | 15-20 | 20-25 | 20-35 |
| Тіосульфат натрію | 0,005-0,001 | 0,002-0,003 | |
| Нікель хлористий (кристалогідрат) | .2-3 | .2-3 | |
| Роданін | 0,003-0,005 | ||
| Миючий засіб "Прогрес" | 0,5-1,0 | ||
| Калій залізосиньородистим | 0,1-0,15 |
Розчин 1 має швидкість осадження міді 0.8-1.0 мкм / год при щільності завантаження 2-2.5 дм 2 / л. Розчин має високу стабільність але менш продуктивний через знижену концентрації солеї міді.
Розчин 2 має швидкість осадження 2-4 мкм / год при щільності завантаження 2-2.5 дм 2 / л. Розчин має більшу продуктивність, але меншою стабільністю.
Розчин 3 відрізняється високою стабільністю і допускає тривалу експлуатацію, що дає можливість отримувати в ньому товсті шари міді.
Хімічне меднение металів поки не має широкого розповсюдження, так як механічні властивості хімічно отриманої міді гірше, ніж електрохімічної і тому хімічне меднение металів обмежено спеціальними випадками.
Практичне застосування розчинів хімічного міднення ускладнюється тим, що вони є нестійкими, тривалість їх використання іноді не перевищує 1-2 ч. Нестійкість розчинів проявляється в тому, що при деяких умовах відновлення Сu (II) починається не тільки на поверхні, що покривається, а й у всьому об'ємі розчину. Так як реакція відновлення Сu (II) формальдегідом протікає автокаталитически, то солі міді та формальдегіду швидко і непродуктивно витрачаються і ванна виходить з ладу.
У розчинах хімічного міднення після тривалого зберігання відбувається розкладання формальдегіду з реакції Канніццаро.
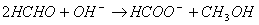
Тому розчини міднення зазвичай готуються в вигляді окремих розчинів, які змішуються безпосередньо перед меднением. У цих розчинах формальдегід і лужні речовини повинні знаходитися окремо. Сіль міді може перебувати з формальдегідом, так як у відсутність лугу відновлення міді не відбувається.
Якщо в розчині присутній металева мідь, то при відновленні міді на каталітичної поверхні збільшується схильність до відновлення її в усьому обсязі.
Можна перерахувати такі чинники, що сприяють відновленню міді у всьому розчині:
1) підвищення концентрації реагуючих речовин - двухвалентной міді, формальдегіду і луги, підвищення температури, а також збільшення співвідношення каталітичної поверхні і об'єму, тобто ступеня завантаження ванни.
2) недостатня кількість ліганда або ліганд, який утворює слабкий комплекс міді
3) присутність у розчині каталізатора відновлення міді частинок металевої міді, відриваються від покриття, або частинок активатора, наприклад, у разі, коли активована поверхню не промивається;
4) будь-які тверді частинки в розчині можуть служити центрами кристалізації і, таким чином, полегшувати освіта зародків металевої міді в об'ємі розчину.
Найпростішою мірою стабілізації розчинів є зменшення їх концентрації. Всі відомі неконцентровані розчини міднення стабільніше концентрованих. Можливі, однак, і заходи стабілізації, що не приводять до зниження швидкості міднення. Такими є:
1) добавка стабілізуючих речовин сполук, що утворюють міцні комплекси з міддю (карбонат, триетаноламін, трилон Б, тіосульфат, залізосиньородистим калій, роданін), поверхнево активних речовин (вищі спирти, жирні кислоти, тощо), які, адсорбируясь на поверхні твердих частинок, можуть блокувати їх, утруднюючи кристалізацію міді. Однак добавки можуть іноді несприятливо впливати на якість покриття.
2) фільтрування розчину для видалення часток каталізатора або інших речовин. При застосуванні безперервного фільтрування cконцентрірованние розчини можна практично використовувати необмежений час, додаючи реактиви в міру їх витрачання.
3) помірна ступінь завантаження (не перевищувати 2.5 дм 2 / л).
4) перемішування розчину будь-яким способом. Перемішування, окрім стабілізації, збільшує швидкість міднення, а також сприяє отриманню більш щільного осаду міді. Тому перемішування можна рекомендувати як простий і ефективний спосіб поліпшення хімічного міднення.
Хімічне меднение можна здійснити шляхом розбризкування розчину за допомогою спеціального пістолета-розпилювача [45]. Процес пульверизації дозволяє наносити шар міді на вироби, занурення яких у ванну важко через великі габарити або з будь-яких інших причин. При меднении шляхом пульверизації завжди застосовують два різних розчину, які за допомогою двоствольного пістолета по двом його каналах подаються до певної ділянки поверхні виробу, де і змішуються.
Специфічною особливістю цього методу є те, що тут можна використовувати і такі розчини, в яких відновлення міді не є автокаталітіческій. Справа в тому, що велика швидкість, необхідна для відновлення, досягається лише в умовах, коли реакція йде у всьому розчині тому при використанні цього методу поряд з формальдегідом, можна застосовувати і інші відновники (наприклад, гіпофосфіт). Необхідну швидкість відновлення міді зазвичай досягають підвищенням температури розчину, з цієї причини більшість запропонованих розчинів працює при температурі 80-90 ° С. Оскільки при настільки високих температурах відбувається розм'якшення багатьох пластмас то ряд авторів прагнув розробити склад розчину міднення при кімнатній температурі. У цьому випадку необхідна швидкість відновлення забезпечувалася наявністю в розчині іонів паладію, платини або золота які, відновлюючись в лужному середовищі формальдегідом утворюють на поверхні виробу безліч каталітично активних центрів. Зазначеним методом можна металлизировать поліетилен, полівінілхлорид, полістирол, керамічні матеріали і т.д. Формалін можна замінити гідразингідрату.
Дата добавления: 2015-07-11; просмотров: 86 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Властивості покриття та умови утворення | | | Хімічне сріблення |