
|
Читайте также: |
Жидкими растворами называются молекулярные смеси двух или нескольких веществ, находящиеся в жидком состояние.
Если одно вещество в растворе присутствует в значительно большем количестве, чем другое, то оно называется растворителем, а другие – растворенными веществами. Если раствор содержит только два вещества, он называется бинарным.
Вещества, входящие в раствор, часто характеризуют так называемой молярной концентрацией, определяемой как отношение числа молей этого вещества в растворе к общему числу молей:
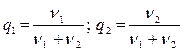 (8.3.1)
(8.3.1)
Ясно, что q1 + q 2= 1.
Молярная концентрация показывает долю атомов (молекул) данного вещества в общем числе молекул (атомов). Действительно,
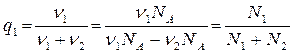 , (8.3.2)
, (8.3.2)
где N1,N2 - число атомов соответствующего вещества.
Раствор может быть получен либо в результате смешения различных жидкостей, либо в результате растворения в жидкости твердых веществ. В первом случае жидкости (например, спирт, вода) смешиваются в любых пропорциях. А при растворении твердых веществ (например, сахар в воде) обычно существует предел концентрации, выше которой вещество уже не растворяется. Максимальная равновесная концентрация называется растворимостью. Растворимость зависит от давления и температуры.
Механизм растворения сводится к разрыву связей между молекулами каждого из исходных веществ и к образованию новых связей между молекулами, находящимися в растворе. Во многих случаях при растворении происходит разрыв связей не только между молекулами, но и между составными частями (например, у солей и щелочей происходит разделение молекул на ионы).
На разъединение молекул и их частей при растворении обычно затрачивается определенная энергия - теплота растворения. Из-за этого процесс растворения в некоторых случаях, когда молекулы или их части, образовавшиеся при растворении, объединяются в комплексы (энергетически более выгодные), то может выделяться теплота растворения (например, при растворении кислоты в воде).
Растворы, теплота растворения которых равна нулю, называются идеальными растворами. Ясно, что в этих растворах характер взаимодействия между молекулами растворенного вещества и растворителя такой же, как и между молекулами растворителя. Поэтому замена некоторого числа молекул растворенного вещества на такое же число молекул растворителя и наоборот не приводит к изменению характера взаимодействия в идеальном растворе.
Из условия равновесия на границе между насыщенным паром и раствором следует, что давление насыщенных паров растворителя над раствором во столько раз меньше их давления над чистым растворителем, во сколько раз уменьшается молярная концентрация растворителя:
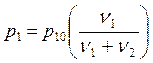 (8.3.3)
(8.3.3)
– это закон Рауля, где р10 – давление насыщенных паров над чистым растворителем, р1 – давление насыщенных паров растворителя над раствором. Аналогичное соотношение имеет место для насыщенных паров растворяемого вещества.
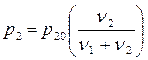 (8.3.4)
(8.3.4)
В общем виде закон Рауля можно записать:
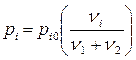 , (8.3.5)
, (8.3.5)
где i = 1,2.
Закон Рауля выполняется только для идеальных растворов или для слабых неидеальных растворов, если речь идет о парах растворителя. Закон Рауля можно прочитать справа налево:
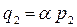 , (8.3.6)
, (8.3.6)
где a= 1/ р20, т.е. молярная концентрация вещества в растворе пропорциональна давлению газа этого вещества над жидкостью (раствором). В такой интерпретации этот закон носит название закона Генри.
Именно поэтому, например, если мы хотим получить газированную воду, то углекислый газ надо подводить к ней под большим давлением.
Дата добавления: 2015-10-21; просмотров: 391 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Поверхностное натяжение. Смачивание. Капиллярные явления. | | | Осмотическое давление. Закон Вант-Гоффа. |