
Читайте также:
|
Реакции электрофильного замещения водорода в кольце ароматических аминов имеют ряд особенностей, обусловленных наличием у атома азота неподеленной электронной пары. С кислотами, которые используются в качестве электрофильных реагентов, амины реагируют, прежде всего, как основания с образованием солей:
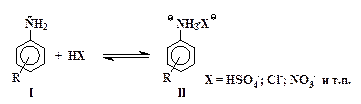
| (1) |
Из двух форм - свободного амина I и его соли II - первая содержит сильный электронодонорный заместитель -NH2, а вторая – сильнейший электроноакцептор - группу -NH3+.
Электрофильное замещение в солях типа II происходит значительно медленнее, чем в молекулах свободных аминов I. Ориентирующее действие амино- и аммонийной группы также различно: группа NH2 – сильный орто - пара -ориентант, а группа -NH3+ направляет электрофильные частицы в мета -положение.
В сильнокислой среде (в концентрированных кислотах: серной, соляной и т.п.) равновесие (1) почти полностью сдвинуто вправо при условии, что ароматическое ядро не содержит сильных электроно-акцепторных заместителей R. Из-за дезактивирующего влияния группы -NH3+ сульфирование анилина до сульфаниловой кислоты при комнатной температуре не происходит. Для сравнения можно указать на то, что при действии концентрированной серной кислоты на фенол последний легко превращается в смесь орто -, пара -сульфокислот и 2,4-дисульфокислоты фенола.
Следует, однако, отметить, что даже в сильнокислых растворах очень активные электрофильные реагенты и окислители способны взаимодействовать со свободным амином, присутствующим в этих условиях в ничтожной концентрации. Например, концентрированная азотная кислота энергично окисляет анилин (в форме I) и в то же время реагирует с его солью (форма II), образуя некоторое количество мета -нитроанилина. При действии концентрированной азотной кислоты на анилин образуется много продуктов осмоления и следы мета -нитроанилина. Для получения из анилина п -нитроанилина, п -броманилина и т.п. приходится прибегать к методу “защиты” аминогруппы, а точнее к ее временной дезактивации путем ацилирования.
Например, п -нитроанилин получают следующим образом:

| (2) |
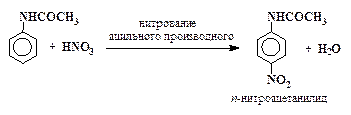
| (3) |
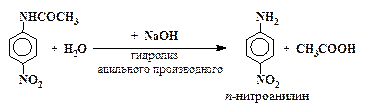
| (4) |
Превращения анилина в сульфаниловую кислоту включают в себя стадии (5 – 7), аналогичные превращениям (2 – 4) с тем отличием, что в случае сульфирования анилина все последовательные реакции проходят в одном сосуде и промежуточные вещества не выделяются.

| (5) |
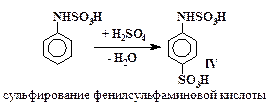
| (6) |
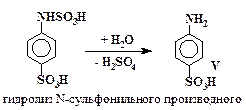
| (7) |
Большинство сульфокислот очень хорошо растворяется в воде. В отличие от них сульфаниловая кислота, как и другие ароматические аминосульфокислоты, сравнительно малорастворима: в 100 мл воды при 20° С может раствориться только около 1 г кислоты. Аминосульфокислоты в кристаллическом состоянии существуют в форме биполярных ионов, которые также называют внутренними солями или цвиттер-ионами. Образование биполярного иона происходит в результате внутримолекулярного взаимодействия аминогруппы, обладающей слабо-основными свойствами, с сульфогруппой, кислотные свойства которой по силе сопоставимы с серной кислотой:
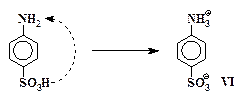
Органические соединения, образующие биполярные ионы, имеют очень прочные ионные кристаллические решетки. Энергии, выделяющейся при гидратации частиц VI, недостаточно для компенсации энергетических затрат, необходимых для разрушения кристаллической решетки сульфаниловой кислоты. Это и является причиной малой растворимости сульфаниловой кислоты в воде.
Контрольные вопросы
1. Напишите уравнения всех промежуточных стадий при превращении анилина в сульфаниловую кислоту. Почему в отличие от фенола анилин при действии серной кислоты не образует сульфокислот при комнатной температуре?
2. Напишите уравнение реакции, на которой основано определение конца процесса превращения анилина в сульфаниловую кислоту.
3. Почему в отличие от большинства других сульфокислот (например, п -толуолсульфокислоты) сульфаниловая кислота малорастворима в воде?
4. Почему малорастворимая в воде сульфаниловая кислота хорошо растворяется в водной щелочи?
5. Какие меры предосторожности надо предпринимать в процессе синтеза сульфаниловой кислоты?
Дата добавления: 2015-10-21; просмотров: 172 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Пояснения к синтезу | | | Основные теоретические положения |