
Читайте также:
|
1901 жылы Америка ғалымы Льюис «активтік» деген ұғым енгізген. Активті концентрация немесе «активтік» - иондардың шартты концентрациясы, ол ерітіндінің қасиеттеріне, сырт жағдайларға байланысты.
Сұйытылған күшті электролит ерітінділерінде СЖ = а. Неғұрлым концентрация жоғары болса, ион «активтігі» төмен болады.
а ≠ С
а = f С
А ктивтік коэффиценті және ерітіндінің иондық күші
f – ионның активтік коэффиценті. Оның мәнін анықтау үшін, түсіну үшін сұйытылған ерітінділерде (10-4моль/л), а = С, яғни f =1.
Осыдан 0 < f < 1
Конц ↔ сұйытылған
Электролит ерітінділерінде иондардың өзара әсерлесуін сипаттайтын ұғым – ерітіндінің иондық күші (I). Ерітіндінің иондық күші электролиттің табиғатына яғни заряды мен концентрациясына тәуелді.
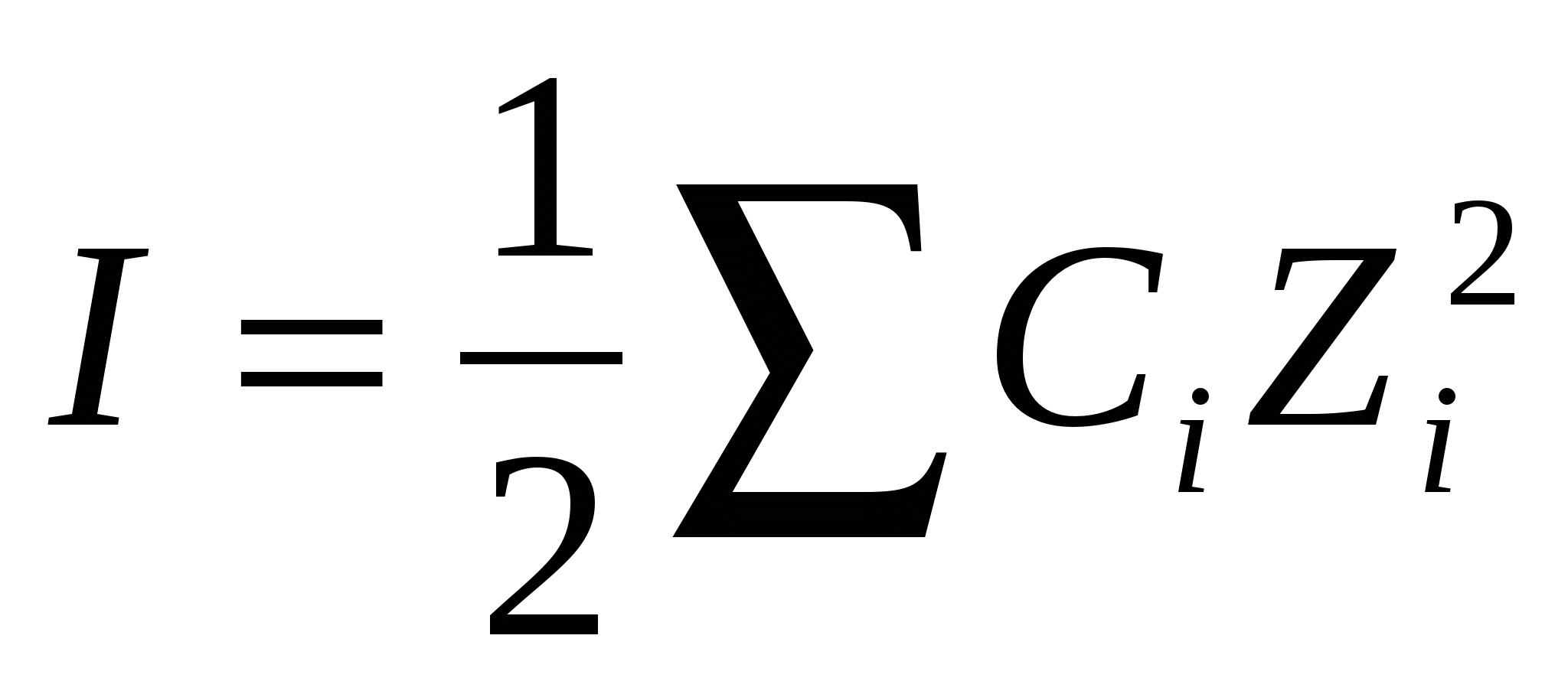
1923 жылы П.Дебай және Е.Хюккель деген ғалымдар ұсынды. 0 < I < 0,1
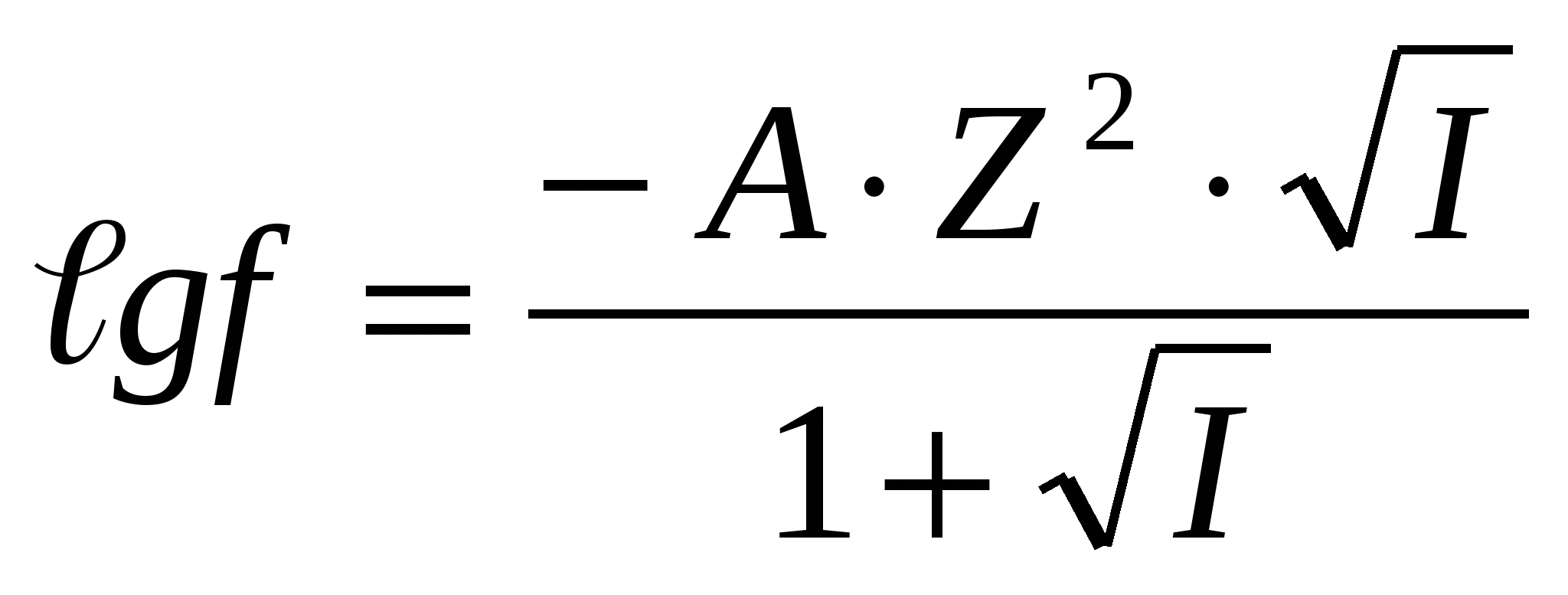 ; сұйытылған ерітінділер үшін, 0 < I< 0,1
; сұйытылған ерітінділер үшін, 0 < I< 0,1
Егер I < 0,01 болса, 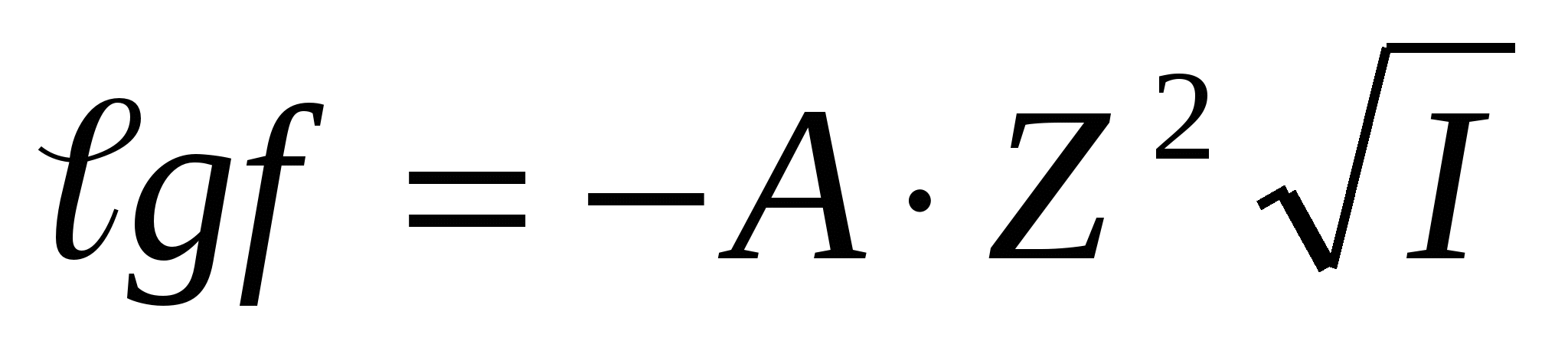 ;
;
Ә рекеттесуші массалар заңы
Химиялық реакциялар жылдамдығы
Химиялық реакцияның жылдамдығына реакцияға қатысатын заттардың:
1. Табиғаты,
2. Әрекеттесуші заттардың концентрациясы,
3. Сыртқы температура,
4. Қысым,
5. Катализатор, т.б әсер етеді.
1867 жылы Норвегия ғалымдары Гульдбер және Вааге қазіргі кезде массалар әрекеттесуші заңы деп белгіленген заңдылықты тұжырымдады: Химиялық реакциялар жылдамдығы стехиометриялық коэффиценттерінің дәрежесімен алынған реакцияласушы заттардың концентрациясының көбейтіндісіне тура пропорционал.
а А + в В = с С + d D
Vтура ≈ [A]a·[B]b; V = k1[A]a [B]b
Vкері ≈ [С]с·[D]d; V = k2[C]c [D]d
k1, k2 – пропорционалды коэффицент (жылдамдық константасы), ол әрекеттесуші заттардың табиғатына, концентрациясына, сыртқы температураға, қысымға, катализаторға тәуелді болуы.
K = V, егер [A] = [B] = 1моль/л
егер V1 = V2, k1[A]a [B]b = k2[C]c·[D]d
k1[A]·[B] = k2[C]·[D]
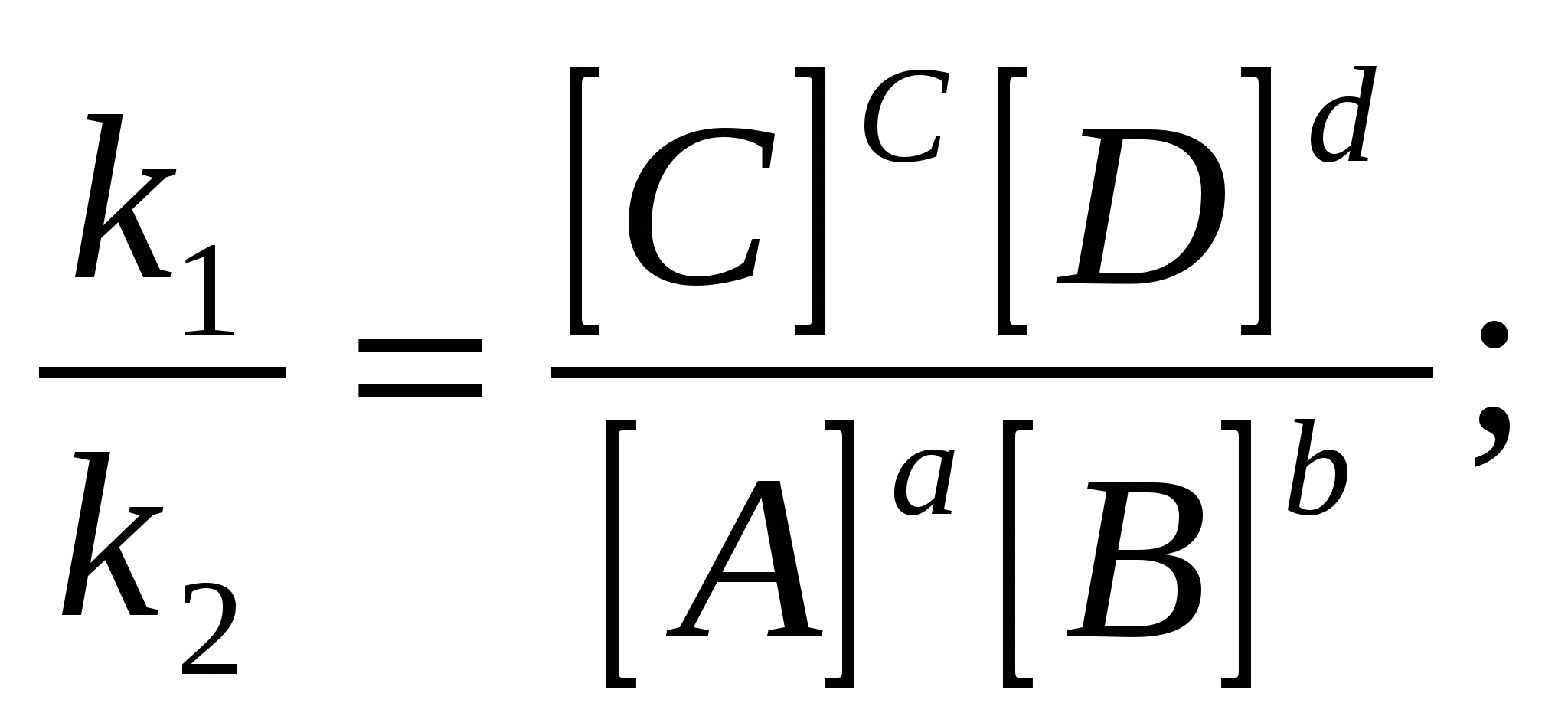
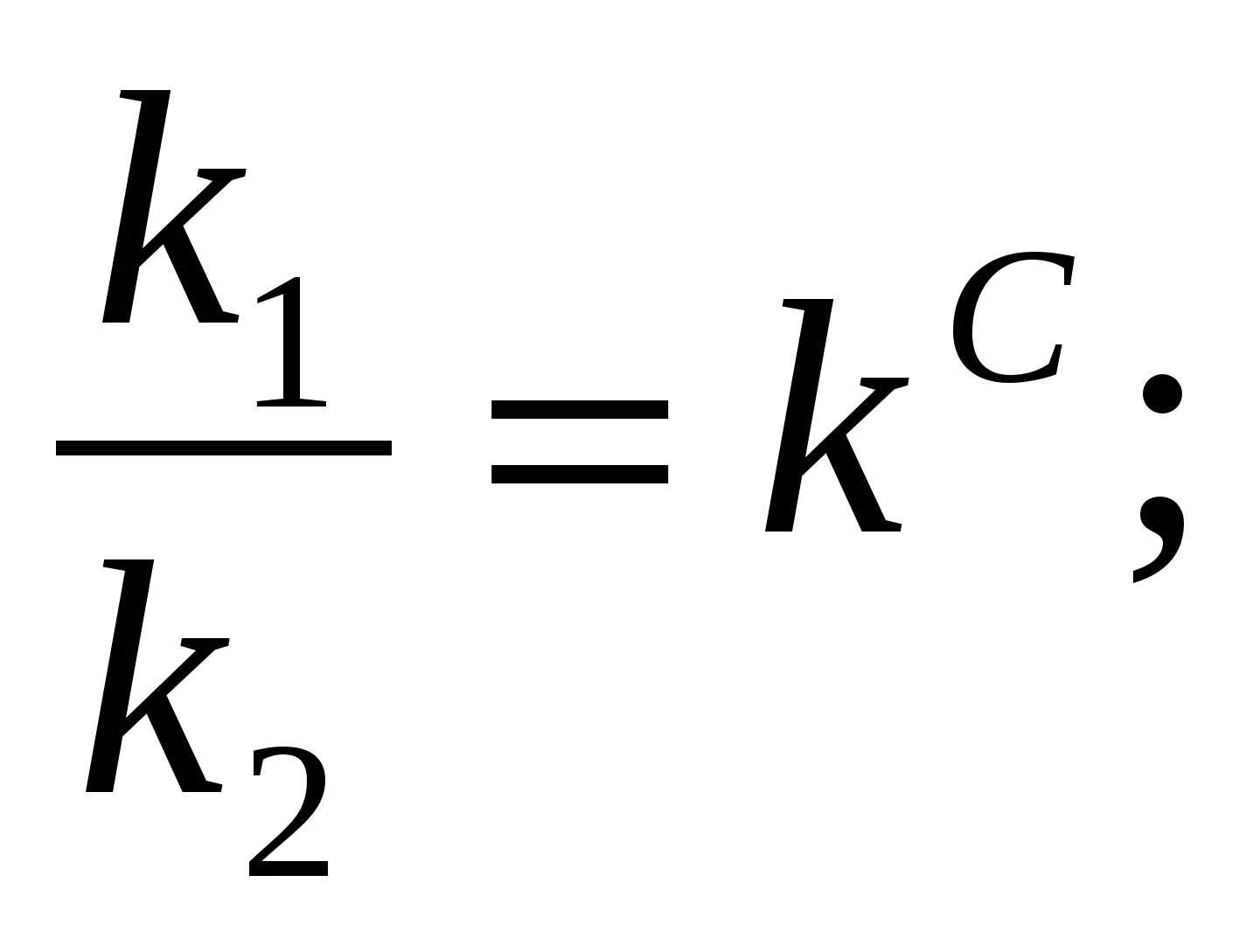
кс – тепе – теңдік константасы немесе концентрациялық константа.
Константаның мәнінен реакцияның бағытын болжауға болады:
Егер, к > 1, тура реакция жүреді де, V1 > V2
к < 1, кері реакцияның жылдамдығы басым, V2 > V1.
Кейінгі кезде константа көрсеткіші пайдаланылатын болды: рК = - ℓgK. Егер рК > 0 болса, реакция кері бағытта, ал рК < 0болса, тура реакция жүреді.
тепе – теңдік константасының түрлері
1. Иондану константасы: НА = Н+ + А-
2. Түзілу константасы:
3. Реакциялардың көбі қайтымсыз.
4. Ерігіштікті, еріткіштікті сипаттайтын константалар КS, (S)
5. Судың иондық көбейтіндісі
6. Гидролиздену константасы KГ
К онцентрациялық және термодинамикалық константалары
Активтік арқылы табылған тепе – теңдік константасын термодинамикалық константасы деп атайды.
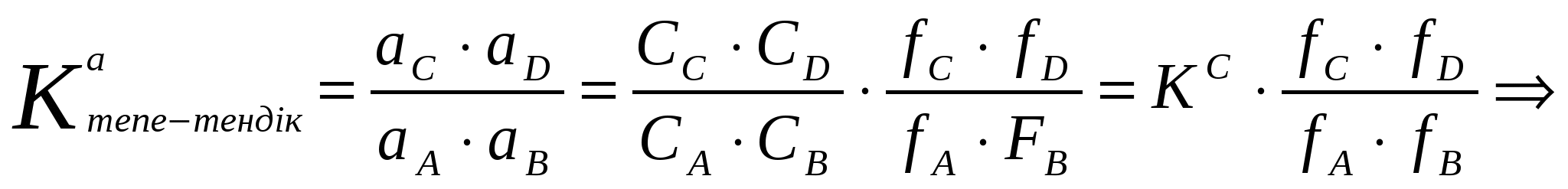
 (кейбір кітаптарда КТермод, КСконс-та деп жазылады).
(кейбір кітаптарда КТермод, КСконс-та деп жазылады).
Әлсіз электролиттер ерітінділерде орнайтын тепе – теңдік. (иондану константасы)
Әлсіз электролиттер ионданғанда тепе – теңдік орнайды.
HAn ↔ H+ + An-; CH+ = CAn-
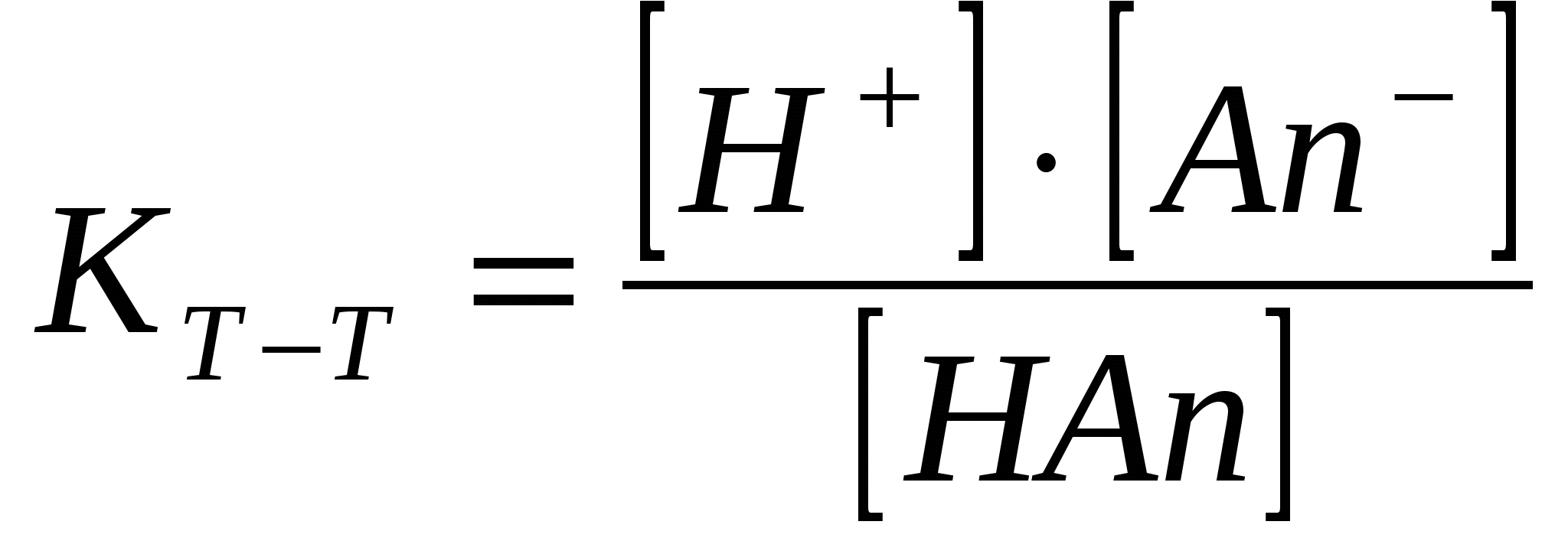 ;
; 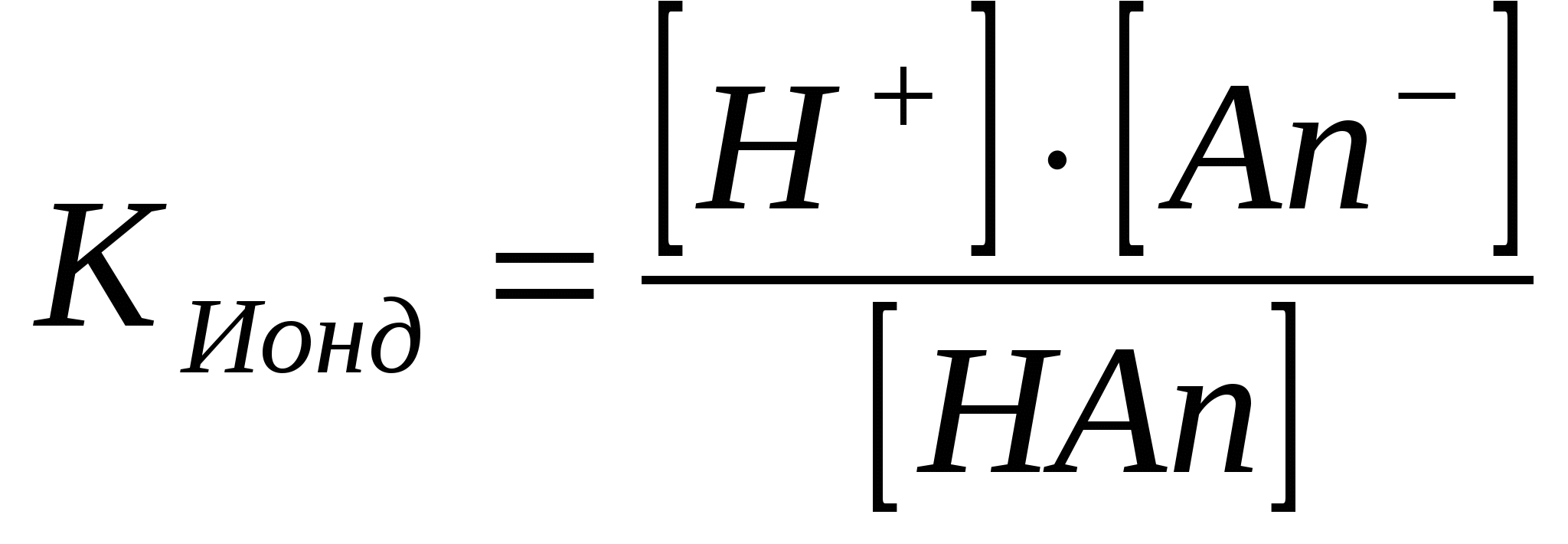
Электролиттің концентрациясы CНAn = СЖ, оның иондану дәрежесі α тең болса, онда түзілген иондардың концентрациясы [H] = [An-] = α СЖ, ал ионданбаған электролиттің концентрациясы [HAn] = СЖ - α СЖ = СЖ(1 – α).
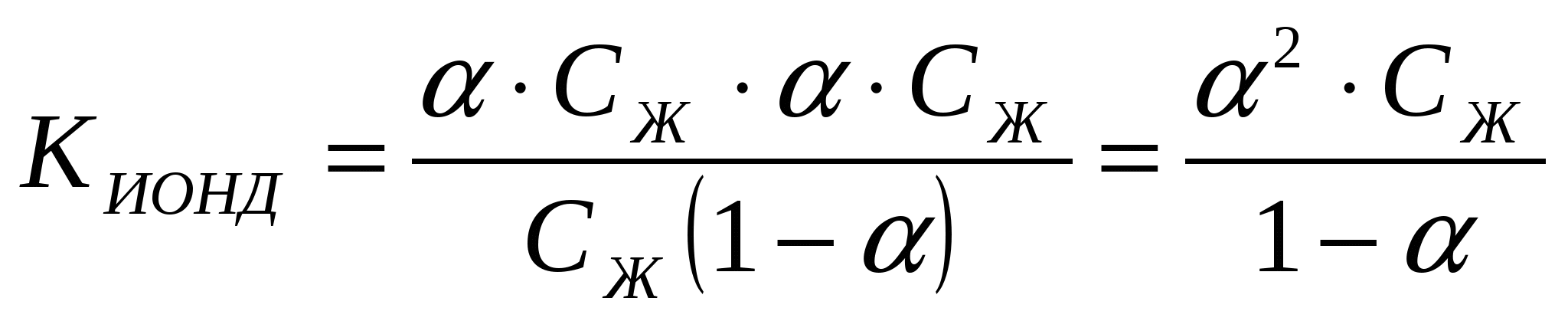
Бұл тәуелділікті Оствальдтың сұйылту заңы деп атайды.
7. Күшті және әлсіз электролиттер. Гомогенді жүйедегі химиялық тепе-теңдіктер
8. Гомогенді тепе-теңдік тұрақтылары – термодинамикалық, концентрациялық, шартты.
Гомогенді (гетерогенді) реакциялар жылдамдығы - процесс кезінде реакцияға түсетін не түзілетін заттардың белгілі (кесімді) уақыт ішінде (секунд, сағат, жыл) көлем бірлігіндегі (қатты заттың бет бірлігіндегі не масса не көлем бірлігіндегі) мөлшері (концентрацияларының өзгерісі): u = Dn / VDt, u = Dn / SDt, n –зат мөлшері,
u = с2 – с1 / t2 - t1 = ± Dс / Dt. Жылдамдықты алғашқы заттардың концентрациясының азайуымен есептесе, онда минус мәні қойылады. Химиялық реакциялардың жылдамдығына температура, реакцияға түсетін заттардың концентрациясы және катализатор әсерін зеттейтін ғылым – деп аталады. Реакциялардың кинетикасын зерттеудің теориялық, практикалық маңызы зор. Температура әсері. Заттар әрекеттесуүшінолардың молекулалары кездесіп, түйісуі керек. Температураны көтергенде молекулалардың қозғалыс жылдамдығы артады, олардың кездесуі де артады. Тәжірибе жүзінде температураны 10° өсіргенде реакцияның жылдамдығы 2 – 4 есе артатындығы анықталған (Вант-Гофф ережесінің дұрыстығы дәлелденген).
Концентрацияның әсері. Химиялық реакциялар тез жүруі үшін түйісетін молекулалар саны көп болуы керек, яғни концентрацияны өсіру керек. Реакцияның жылдамдығына әрекеттесуші заттардың концентрацияларының әсерін зерттеген Норвегияның екі ғалымы Гульдберг және Вааге 1867 жылы мынадай қорытындыға келген: химиялық реакцияның жылдамдығы реакцияласушы заттардың концентрацияларының көбейтіндісіне тура пропорционал - әрекеттесуші массалар заңы. Егер химиялық реакциялар жалпы түрде былай жүрсе: а А + b В = сС + d D, молярлы концентрация С деп белгіленсе, u = k CAa ×CB b , мұндағы k – пропорционалдық коэффициент, реакция жылдамдығының константасы деп аталады. Егер реакцияға қатты зат қатысатын болса, олар бар массасымен емес, тек сыртқы бетімен ғана реакцияласады, сондықтан реакцияның жылдамдығын анықтағанда оның концентрациясы есепке алынбайды; газ және еріген заттардың концентрациясы ғана есептеледі. Мысалы, С + СО2 = 2 СО, u = k C СО2 және Ғе2 О3 + 3Н2 = 2Ғе + 3Н2 О, u = k C Н2 .
Шартты константа. Өте аз ерітінділер үшін қолданылады.бұл жерде ерітіндісінің құрамындағы компоненттердің мольдік үлесіне тәуелді.Реакция барысында активті коэффицент 1 ден аз, өте аз мән деп алсақ, жалпылама тепе- теңдік конц константа;реакция барысында тепе- теңдік константасының физикалық мәні реакцияның бағытын көрсетеді. Яғни, к>1 тура реакция басым, к <1 кері реакция басым, кей жағдайда тепе – теңдік константа көрсеткіш арқылы беріледі.
PK = -lgK константа көрсеткіші
9. Ерітінділердегі қышқыл-негіздік тепе-теңдік, Бренстед-Лоури теориясы. Судың иондық көбейтіндісі және сутектік көрсеткіші
Электролиттік диссоцияция теор б – ша ерітінділер екі түрде бөлінеді
1.Күшті негіздер, күшті қышқылдар
2.Әлсіз негіз, әлсіз қышқылдар
Осындай электролиттің күштілігінің PH – на қарай анықтау жолдары әр түрлі.Күшті негіздер және күшті қышқылдар ерітіндіді толық диссоцияуиялатындықтан орта қышқылдылығы тікелей сутек және ОН иондарының конц- на тәуеді.Ал, ерітіндіді әлсіз негіздер мен әлсіз қышқыл толық дис- байтын болса, бұл ерітінділердің диссоц. Константасын пайдалана отырып ортаның рН ын анықтайды.
1923 жылы Бренстед –Лоури сутек иондарының конц –ын есептеуге болатын және барлық орг. Қосылыстарға жарамды орг. Қосылыстар үшін тиімді протолиттік ілімді ұсынды.Ол ілім б- ша реакция нәтижесінде жаңа қышқыл мен жаңа негіз пайда болды НА1 +В = ВН +А. Яғни,осы протолиттік ілім бойынша ең қажетті компоненттік еріткіш.Ерітіндінің қасиеті бойынша 3 топқа бөлеміз
1.Апротонды
2.Протофилді
3.Амфипротты
Сутек және ОН иондары тепе –теңдік концентрация арқ берілсе Кп =[Н][ОН]- судың иондық көбейтіндісі
10. Күшті қышқыл және күшті негіз ерітінділерінің рН есептеу
Күшті негіздер және күштк қышқылдар ерітіндіде толық диссоцияциялатындықтан орта қышқылдылығы тікелей сутек және ОН иондарының конц- на тәуеді. Мысалы
1 С(NaOH)= 0.1 моль/л
т/к рН =?
NaOH = Na + OH
pOH = -lg[OH] = -lg0.1 =1
pH = 14-1=13 коэффициент үнемі ескерілуі керек.
11. Әлсіз қышқыл және әлсіз негіз ерітінділерінің рН есептеу
Ерітіндіде әлсіз негіздер мен әлсіз қышқыл толық дис- байтын болса, бұл ерітінділердің диссоц. Константасын пайдалана отырып ортаның рН ын анықтайды. Мысалы
С (NH4OH)= 0.01 моль/л
K(NH4OH) =1.75 * 10 (-5)дәрежесі
т/к pH =?
NH4OH = NH4 +OH
Kb = [NH4][OH]/[NH4OH] Ерітіндіде қышқылдар мен негіздердің конц төмен болғандықтан NH4 және OH иондары тең болады.
[NH4]= [OH]
Kb = [OH] (2) квадраты /[NH4OH]
[OH] = түбір астында Kb*[NH4Oh]= 1.75*10 (-5) дәрежесі * 10 (-2) дәрежесі = түбір астында 0.175 *10 (-6) дәрежес = 0.42 * 10 (-3) дәрежес
pOH - -lg.42 * 10 (-3) дәрежес = -(lg0.42 +lg10 (-3) дәрежес) = -(-0.38 -3)=3.38
pH = 14-3.4+ 10.6
12. Буферлі ерітінділерінің рН-ын анықтау жолдары, мысал келтіріңіз
Буферлі жүйелер (Буферлі ерітінділер)
Қышқыл буфер қоспалары:
Қ  ышқыл а) CH3COOH + CH3COONa (pH 4,7) ацетатты
ышқыл а) CH3COOH + CH3COONa (pH 4,7) ацетатты
ортада Қышқыл Негіз
б) НСООН + НСООNa (pH 3,7) формиатты
Қышқыл Негіз 
Сілтілік в) Na2HPO4 + NaH2PO4 (pH 6,8) фосфатты
ортада Негіз Қышқыл
г) Na2СO3 + NaHСO3 карбонатты
Негіз Қышқыл
Негіздік буфер қоспаларына аммонийді NH4OH + NH4CI (рН 9,8). Адам қанының рН – ы 1,36 тең. Қанның негізгі буфері - Na2СO3 + NaHСO3. Клетка сұйықтарының буфері - Na2HPO4 + NaH2PO4.
Буфферлік қоспалардағы протолиттік тепе – теңдік (рН)
Қышқылдық жүйелердің рН есептеу:
CH3COOH ↔ CH3COO- + Н+ HAn + Н2О ↔ Н3О+ + An- немесе
CH3COONa ↔ CH3COO- + Na+ қарапайым түрі HAn ↔ Н+ + An-
Дата добавления: 2015-09-07; просмотров: 1477 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Была ли альтернатива Сталину? | | | Тема 7, вопрос 3. Роль церкви в общественно – политической жизни. |