
|
Читайте также: |
ІІ етапу Всеукраїнської олімпіади з хімії серед студентів
класичних університетів
Теоретичний тур
Донецьк, 2010 р.
ЗАДАЧА 1. Легкокиплячий циклічний нерозгалужений вуглеводень А (С5Н6) (tкип = 410С), виділяють реакцією Дільса-Альдера з фракцій піролізу сировини нафти та коксування вугілля, що киплять вище 1500С. Вуглеводень B, гомолог речовини А, було отримано внаслідок багатостадійного синтезу з речовини C, молекулярна формула якої С5Н10Br2 (Роуз, 1961 р.):

У реакції з малеїновим ангідридом А дає два ізомери – І (98,5 %) та ІІ (1,5 %), при цьому, під час підвищення температури частка ІІ збільшується.
1. Напишіть схему реакції, на якій ґрунтується метод виділення А з продуктів піролізу.
2. Встановіть будову B, якщо ПМР спектр С5Н10Br2 містить два синглети зі співвідношенням інтегральних інтенсивностей 3: 2.
3. Напишіть схеми вказаних реакцій із відображенням структурних формул проміжних речовин.
4. Запропонуйте структурні формули І та ІІ. Поясніть причину переходу І в ІІ під час нагрівання.
5. На які продукти слід чекати в випадку реакції B з малеїновим ангідридом? Поясніть, яка з речовин, А чи B, реагує швидше та чому.
ЗАДАЧА 2. Під час нагрівання простої речовини А утворюється жовта бінарна сполука АХ n. В наслідок розчинення 0,711 г АХ n в 100 мл Н2О утворюється розчин сполуки Б та виділяється 168 мл газу Г (н.у., ρ = 1,429 г/л).
1. Розшифруйте речовини та напишіть рівняння реакцій.
2. Визначте кратність зв’язку в аніонах сполук AX n (lX–X = 1,32 Å), A 2 X n (lX–X = 1,5 Å), AX n+1 (lX–X = 1,42 Å) (метод МО). Запропонуйте спосіб їх добування.
3. Наведіть структурні формули Х 3 (lX–X = 1,28 Å), Х 2 (lX–X = 1,20 Å) та N X 3 (lX–X = 1,21 Å) (метод ВЗ).
4. Поясніть, чому NO2 дає міцний димер, NO – неміцний, а аніон Х  – не дає димеру (метод МО).
– не дає димеру (метод МО).
ЗАДАЧА 3. Речовину С можна одержати конденсацією сполук А та В під дією натрій гідриду в ДМСО з наступним гідролізом. Речовина С існує в трьох таутомерних формах – С1, С2 та С3. Дві з яких, С2 та С3, володіють помітною кислотністю та можуть бути позначені як Н L. Нижче наведено схему перетворень за участю С. У кожному з вказаних перетворень може приймати участь будь-яка форма С.

1. Розшифруйте речовини А – G та напишіть схему їх перетворень, якщо: в молекулі В два атоми Оксигену, а в А – тільки один; число атомів Карбону та Гідрогену в А та В однакове; маси А та В у реакції дорівнюють 1,392 г та 1,776 г відповідно; масова частка Х в Х Cl4 в 2,83 рази менша, ніж в Х О2.
2. Зобразіть структурні формули сполук у схемі. Порівняйте довжини зв’язків С–О в С1, С2, С3 та L –.
3. Запропонуйте механізм реакції С → Е.
4. У водному розчині С (С = 0,100 моль/л, рН = 4,97) існують рівноваги:
С1 = H+ + L – (K1); (C2 + C3) = H+ + L – (K2);
C1 = (C2 + C3) (K3); { C1 + (C2 + C3)} = H+ + L – (K4).
Обчисліть К1 ÷ К4, якщо в УФ-спектрі розчину С співвідношення інтенсивностей смуг поглинання λ1 ≈ 250 нм та λ2 ≈ 300 нм становить 4,65: 1 (вважайте, що ε1 ≈ ε2).
5. Розрахуйте концентрації [ C1 ], [(C2 + C3)] та [ L –] в 0,1 моль/л розчині С за рН = 9.
6. Виберіть фактори, які впливають на співвідношення [ C1 ]: [(C2 + C3)] та обґрунтуйте вибір: а) концентрація; б) рН; в) температура.
7. Вкажіть причину, за якої [ C1 ] > [(C2 + C3)] у водному розчині, [(C2 + C3)] > [ C1 ] у гексані.
ЗАДАЧА 4. Зразок неочищеної шпінелі (0,0500 г) обережно сплавили з КО2 + КОН, плав обробили Н2О з утворенням лужного розчину двох ізоморфних аніонів. Під час нейтралізації розчину до слаболужного середовища випадає осад (0,01006 г), а в жовтому розчині залишається один із аніонів. Розчин довели до 200 мл концентрованою H2SO4, відібрали 50 мл червоного розчину, нейтралізували до оранжевого кольору та для визначення вмісту металу А провели кулонометричне титрування електрогенерованими іонами Cu+ за І = 0,0300 А протягом τ = 7 хв. 33 сек.
1. Розшифруйте речовини, якщо під час прожарювання осаду утворюється 0,00752 г оксиду. Напишіть рівняння реакцій, які перебігають під час підготовки зразку та під час титрування.
2. Визначте масові частки шпінелі та А в зразку.
3. Намалюйте структурні формули в жовтому, оранжевому та червоному (після H2SO4) розчинах.
4. У нейтралізованому до рН = 7 жовтому розчині є три аніони: Х 2–, Н Х – та Х 22–. Визначте їх концентрації, якщо для Н2 Х К2 = 3,2∙10–7, а для 2 Н Х – ⇆ Х 22– + Н2О К = 37,8.
ЗАДАЧА 5. Ступінь термічної дисоціації СО2 на СО та О2 за Т1 = 1400 К та тиску Р, атм дорівнює 1,50∙10–2 %, а за Т2 = 1473 К та тиску 2Р дорівнює 2,82∙10–2 %. Теплоємкості  ;
; 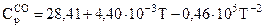 ;
;  ; ΔН2980 реакції +574 кДж.
; ΔН2980 реакції +574 кДж.
1. Розрахуйте  реакції без використання теплоємкості.
реакції без використання теплоємкості.
2. Розрахуйте ΔН14000 та ΔН14730 та порівняйте з  .
.
3. Визначте ступінь перетворення та склад газової суміші, якщо Кр = Р.
4. У системі 2 СО + О2 = 2 СО2 ΔG1 = 0 (стан 1). Рівновагу зсунули збільшенням об’єму та дочекалися поки ΔG2 = 0 (стан 2). Порівняйте концентрації всіх речовин у стані 1 та 2. Обґрунтуйте напрямок зсуву рівноваги за допомогою рівняння ізотерми.
ЗАДАЧА 6. Реакцію ClO– + Br– ⇆ BrO– + Cl– вивчали за 250С, рН = 14, С(СlO–) = 1∙10–2 моль/л, C(Br–) = 1 моль/л.
1. Розрахуйте ΔG0 та КС реакції, якщо
BrO– + H2O + 2e– = Br– + 2 OH– E10 = 0,78 B,
ClO– + H2O + 2e– = Cl– + 2 OH– E20 = 0,88 B.
2. Обчисліть ступінь перетворення ClO– на Сl– (α) та оцініть зворотність реакції.
3. Вважаючи концентрації кислот стаціонарними, виведіть кінетичне рівняння, якщо механізм представлений схемою:
ClO– + H2O ⇆ HClO + OH– (k1, k–1; K)
HClO + Br– → HBrO + Cl– (k2)
HBrO + OH– → BrO– + H2O (k3)
4. Розрахуйте K та k2, якщо початкова швидкість складає 8∙10–6 моль/(л∙с), константа дисоціації HClO Ka = 2,78∙10–8 та KW = 1∙10–14.
5. Уточніть кінетичне рівняння, враховуючи кислотно-основну рівновагу, та побудуйте графік W = f(pH) за рН = 4, 5, 7, 9, 11, 14.
Дата добавления: 2015-09-06; просмотров: 182 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Так и столько живут! | | | Розв’язок 4. |